
A | B | C | D | E | F | G | H | CH | I | J | K | L | M | N | O | P | Q | R | S | T | U | V | W | X | Y | Z | 0 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9
| Molybdenan sodný | |
|---|---|
 Vzhled | |
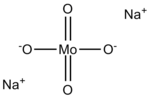 Strukturní vzorec | |
 Krystalická struktura dihydrátu | |
| Obecné | |
| Systematický název | molybdenan sodný |
| Ostatní názvy | molybdenan disodný |
| Anglický název | Sodium molybdate Disodium molybdate |
| Německý název | Natriummolybdat |
| Sumární vzorec | Na2MoO4 |
| Vzhled | bílý prášek |
| Identifikace | |
| Registrační číslo CAS | (bezvodý)&Units=SI 7631-95-0 (bezvodý) 10102-40-6 (dihydrát) |
| EC-no (EINECS/ELINCS/NLP) | 231-551-7 |
| PubChem | 4384450 |
| Číslo RTECS | QA5075000 |
| Vlastnosti | |
| Molární hmotnost | 205,92 g/mol (bezvodý) 241,95 g/mol (dihydrát) |
| Teplota tání | 687 °C |
| Hustota | 3,780 g/cm3 |
| Index lomu | 1,714 |
| Rozpustnost ve vodě | 84 g/100 ml (100 °C) |
| Bezpečnost | |
| [1] Varování[1] | |
| NFPA 704 |  0
2
0
|
| Teplota vznícení | nehořlavý |
Některá data mohou pocházet z datové položky. | |
Molybdenan sodný (Na2MoO4) je sodná sůl kyseliny molybdenové. Často se vyskytuje jako dihydrát Na2MoO4·2H2O.
Příprava
Molybdenan sodný se připravuje rozpouštěním oxidu molybdenového v roztoku hydroxidu sodného při 50–70 °C, krystalizací a filtrací,[2] bezvodá forma se připravuje zahřátím na 100 °C:
- MoO3 + 2 NaOH → Na2MoO4·2H2O
Použití
Na2MoO4 se dá použít jako zdroj molybdenu.
V zemědělství se jej spotřebuje 450 tun ročně jako umělé hnojivo, například pro pěstování brokolice nebo květáku. Potravinářský průmysl ho používá pro výrobu některých potravinových doplňků.[3]
Dále se používá v průmyslu jako inhibitor koroze.[2]
Struktura
Molybdenanový aniont má tetraedrickou strukturu, na každý aniont připadají dva kationty sodíku.[2]
Reakce
Reakcí s tetrahydridoboritanem sodným se molybden redukuje na oxid s nižším oxidačním číslem[4]:
Molybdenan sodný také reaguje s dithiofosforečnanovými kyselinami[2]:
- Na2MoO4 + (RO)2PS2H (R = Me, Et) →
které dále reagují za vzniku .
Bezpečnost
Molybdenan sodný nesmí přijít do styku s alkalickými kovy, většinou běžných kovů a oxidačními činidly. Při dotyku s roztaveným hořčíkem exploduje, nebezpečně reaguje s interhalogeny (fluorid jodistý, fluorid bromičný atd.).[5]
Reference
V tomto článku byl použit překlad textu z článku Sodium molybdate na anglické Wikipedii.
- ↑ a b Sodium molybdate. pubchem.ncbi.nlm.nih.gov . PubChem . Dostupné online. (anglicky)
- ↑ a b c d Braithwaite, E.R.; Haber, J. Molybdenum: An outline of its Chemistry and Uses. 1994. Elsevier Science B.V. Amsterdam, The Netherlands.
- ↑ Molybden z potravin tělu stačí. Nejsme v Íránu
- ↑ Chi Fo Tsang and Arumugam Manthiram. Journal of Materials Chemistry 1997. 7(6). 1003–1006.
- ↑ http://www.mallbaker.com/americas/msds/english/s4394_msds_us_default.pdf[nedostupný zdroj
Externí odkazy
 Obrázky, zvuky či videa k tématu Molybdenan sodný na Wikimedia Commons
Obrázky, zvuky či videa k tématu Molybdenan sodný na Wikimedia Commons - http://lpi.oregonstate.edu/infocenter/minerals/molybdenum/
Text je dostupný za podmienok Creative Commons Attribution/Share-Alike License 3.0 Unported; prípadne za ďalších podmienok. Podrobnejšie informácie nájdete na stránke Podmienky použitia.
Antropológia
Aplikované vedy
Bibliometria
Dejiny vedy
Encyklopédie
Filozofia vedy
Forenzné vedy
Humanitné vedy
Knižničná veda
Kryogenika
Kryptológia
Kulturológia
Literárna veda
Medzidisciplinárne oblasti
Metódy kvantitatívnej analýzy
Metavedy
Metodika
Text je dostupný za podmienok Creative
Commons Attribution/Share-Alike License 3.0 Unported; prípadne za ďalších
podmienok.
Podrobnejšie informácie nájdete na stránke Podmienky
použitia.
www.astronomia.sk | www.biologia.sk | www.botanika.sk | www.dejiny.sk | www.economy.sk | www.elektrotechnika.sk | www.estetika.sk | www.farmakologia.sk | www.filozofia.sk | Fyzika | www.futurologia.sk | www.genetika.sk | www.chemia.sk | www.lingvistika.sk | www.politologia.sk | www.psychologia.sk | www.sexuologia.sk | www.sociologia.sk | www.veda.sk I www.zoologia.sk

