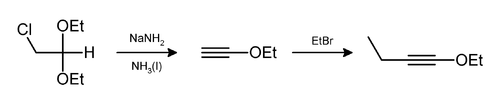A | B | C | D | E | F | G | H | CH | I | J | K | L | M | N | O | P | Q | R | S | T | U | V | W | X | Y | Z | 0 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9
| Amid sodný | |
 | |
 | |
| Všeobecné vlastnosti | |
| Sumárny vzorec | NaNH2 |
| Synonymá | Azanid sodný |
| Fyzikálne vlastnosti | |
| Molárna hmotnosť | 39,01 g/mol |
| Ďalšie informácie | |
| Číslo CAS | 7782-92-5 |
| Pokiaľ je to možné a bežné, používame jednotky sústavy SI. Ak nie je hore uvedené inak, údaje sú za normálnych podmienok. | |
Amid sodný,[1] systematicky azanid sodný, je anorganická soľ zložená zo sodného katiónu a azanidového aniónu. Táto pevná látka je biela, ale komerčné vzorky majú zvyčajne šedú farbu, pretože obsahujú železo prítomné po manufaktúre. Tieto nečistoty zvyčajne neovplyvňujú jeho použitie ako reakčné činidlo.[chýba zdroj Amid sodný prudko reaguje s vodou a pri reakcii vzniká hydroxid sodný a amoniak. Ako tavenina vedie prúd a jeho vodivosť je podobná s vodivosťou taveniny hydroxidu sodného. Amid sodný sabežne využíva ako silná zásada v organickej syntéze.
Príprava a štruktúra
Amid sodný vzniká reakciou sodíka s plynným amoniakom,[2] ale zvyčajne sa pripravuje reakciou v kvapalnom amoniaku, kde sa používa dusičnan železitý ako katalyzátor. Reakcia je najrýchlejšia pri bode varu amoniaku, teda asi -33 °C. V priebehu reakcie vzniká elektrid +e−.[3]
- 2 Na + 2 NH3 → 2 NaNH2 + H2
Amid sodný je materiál podobný soli a takisto kryštalizuje ako nekonečný polymér.[4] Okolie sodíka tvorí tetraédrickú mriežku.[5] V amoniaku tvorí amid sodný vodivé roztoky, čo je konzistentné s prítomnosťou iónov Na(NH3)6+ a NH2− .
Použitie
Amid sodný sa používa hlavne ako silná zásada v organickej chémii, často v roztoku kvapalného amoniaku. Je to bežne používané činidlo na sušenie amoniaku (kvapalného alebo plynného).[chýba zdroj Jednou z jeho hlavných výhod je to, že pôsobí hlavne ako nukleofil. V priemyselnej výrobe indiga je amid sodný súčasťou veľmi zásaditej zmesi, ktorá spôsobuje cyklizáciu N-fenylglycínu. Počas reakcie vzniká amoniak, ktorý sa zvyčajne recykluje.[6]

Dehydrohalogenácia
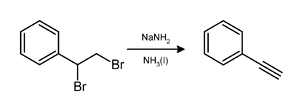
Amid sodný spôsobuje stratu dvoch ekvivalentov brómovodíka z vicinálneho dibrómoalkánu, čím vzniká trojitá väzba uhlík-uhlík, napríklad pri tvorbe fenylacetylénu.[7] Pri použití dvoch ekvivalentov amidu sodného zvyčajne vzniká žiadaný alkín. Tri ekvivalenty sú však nutné pri príprave terminálnych alkínov, pretože terminálna CH skupina protónuje jeden ekvivalent zásady (amidu sodného).
Podobne môže byť eliminovaný chlorovodík a etanol,[8][9][10][11] ako je to pri príprave 1-etoxy-1-butínu:[12]
Cyklizačné reakcie
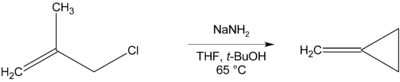
Ak nie je prítomný beta vodík, ktorý by bolo možné eliminovať, môžu vznikať cyklické zlúčeniny, ako napríklad pri príprave metyléncyklopropánu:[13]
Podobným spôsobom je možné pripraviť cyklopropény,[14] aziridíny[15] a cyklobutány.[16]
Deprotonácia kyslých vodíkov viazaných na uhlík a dusík
Kyslé vodíky viazané na uhlíkové atómy je možné deprotonovať amidom sodným v kvapalnom amoniaku, vrátane terminálnych alkínov,[17][18][19] metylketónov,[20] cyklohexanónu,[21] kyseliny fenyloctovej a jej derivátov[22][23][24] a difenylmetánu.[25] Acetylacetón stráca dva protóny, čím z neho vzniká dianión.[26][27] Amid sodný deprotonuje aj indol[28] a piperidín.[29]
Príbuzné nenukleofilné zásady
Amid sodný je však málo rozpustný v iných rozpúšťadlach než je amoniak. V mnohých prípadoch ho nahradili príbuzné činidlá, ako sú hydrid sodný (NaH), bis(trimetylsilyl)amid sodný (NaHMDS) a lítium-diizopropylamid (LDA).
Iné reakcie
Amid sodný možno použiť i pri ďalších reakciách, napríklad:
- Prešmyk s ortodeprotonáciou[30]
- Syntéza oxiránu[31]
- Syntéza indolu[32]
- Chichibabinova reakcia
Bezpečnosť
Amid sodný prudko reaguje s vodou, čím vzniká amoniak a hydroxid sodný. Na vzduchu horí za vzniku oxidov sodíka a oxidu dusičitého.
- NaNH2 + H2O → NH3 + NaOH
- 4 NaNH2 + 7 O2 → 2 Na2O + 4 NO2 + 4 H2O
V prítomnosti obmedzeného množstva vzduchu a vlhkosti, napríklad v zle uzatvorených nádobách, sa môžu tvoriť výbušné zmesi peroxidov.[33] Počas toho látka žltne alebo hnedne. Amid sodný by teda mal byť skladovaný v dobre uzatvorených nádobách a v atmosfére inertného plynu. Vzorky amidu sodného, ktoré sú žltej alebo hnedej farby, predstavujú riziko výbuchu.[34]
Referencie
- ↑ amidy kovov . Encyclopaedia Beliana, . Dostupné online.
- ↑ Sodium amide . www.orgsyn.org, . Dostupné online. (po anglicky)
- ↑ Greenlee, K. W.; Henne, A. L.. Inorganic Syntheses. : , 1946. ISBN 9780470132333. DOI:10.1002/9780470132333.ch38 Sodium Amide, s. 128–135.
- ↑ The Crystal Structure Of Sodium Amide. Journal of Physical Chemistry, 1956, s. 821–823. DOI: 10.1021/j150540a042.
- ↑ Wells, A. F.. Structural Inorganic Chemistry. Oxford : Clarendon Press, 1984. ISBN 0-19-855370-6.
- ↑ LANGE, Ludwig; TRIEBEL, Wolfgang. Sodium Amide. : John Wiley & Sons, Ltd, 2000. DOI: 10.1002/14356007.a24_267. Dostupné online. ISBN 978-3-527-30673-2. DOI:10.1002/14356007.a24_267 (po anglicky)
- ↑ Phenylacetylene . www.orgsyn.org, . Dostupné online. (po anglicky)
- ↑ Ethoxyacetylene . www.orgsyn.org, . Dostupné online. (po anglicky)
- ↑ Di-tert-butoxyethyne . www.orgsyn.org, . Dostupné online. (po anglicky)
- ↑ Phenylthioacetylene . www.orgsyn.org, cit. 2022-01-25. Dostupné online. (po anglicky)
- ↑ 2-Butyn-1-ol online. www.orgsyn.org, cit. 2022-01-25. Dostupné online. (po anglicky)
- ↑ 1-Ethoxy-1-butyne online. www.orgsyn.org, cit. 2022-01-25. Dostupné online. (po anglicky)
- ↑ Cyclobutanone from methylenecyclopropane via oxaspiropentane online. www.orgsyn.org, cit. 2022-01-25. Dostupné online. (po anglicky)
- ↑ Synthesis and (3+2)-cycloaddition of a 2,2-dialkoxy-1-methylenecyclopropane: 6,6-dimethyl-1-methylene-4,8-dioxaspiro(2.5)octane and cis-5-(5,5-dimethyl-1,3-dioxan-2-ylidene)hexahydro-1(2H)-pentalen-2-one online. www.orgsyn.org, cit. 2022-01-25. Dostupné online. (po anglicky)
- ↑ N-Ethylallenimine online. www.orgsyn.org, cit. 2022-01-25. Dostupné online. (po anglicky)
- ↑ 1-Cyanobenzocyclobutene online. www.orgsyn.org, cit. 2022-01-25. Dostupné online. (po anglicky)
- ↑ 1-Ethynylcyclohexanol online. www.orgsyn.org, cit. 2022-01-25. Dostupné online. (po anglicky)
- ↑ (Z)-4-Chloro-4-hexenyl trifluoroacetate online. www.orgsyn.org, cit. 2022-01-25. Dostupné online. (po anglicky)
- ↑ Tetrolic acid online. www.orgsyn.org, cit. 2022-01-25. Dostupné online. (po anglicky)
- ↑ Dimethylethynylcarbinol online. www.orgsyn.org, cit. 2022-01-25. Dostupné online. (po anglicky)
- ↑ 2-Allylcyclohexanone online. www.orgsyn.org, cit. 2022-01-25. Dostupné online. (po anglicky)
- ↑ α,β-Diphenylpropionic acid online. www.orgsyn.org, cit. 2022-01-25. Dostupné online. (po anglicky)
- ↑ Ethyl 2,4-diphenylbutanoate online. www.orgsyn.org, cit. 2022-01-25. Dostupné online. (po anglicky)
- ↑ α,β-Diphenylcinnamonitrile online. www.orgsyn.org, cit. 2022-01-25. Dostupné online. (po anglicky)
- ↑ 1,1-Diphenylpentane online. www.orgsyn.org, cit. 2022-01-25. Dostupné online. (po anglicky)
- ↑ Phenylation of diphenyliodonium chloride: 1-phenyl-2,4-pentanedione online. www.orgsyn.org, cit. 2022-01-25. Dostupné online. (po anglicky)
- ↑ 2,4-Nonanedione online. www.orgsyn.org, cit. 2022-01-25. Dostupné online. (po anglicky)
- ↑ 1-Methylindole online. www.orgsyn.org, cit. 2022-01-25. Dostupné online. (po anglicky)
- ↑ N-β-Naphthylpiperidine online. www.orgsyn.org, cit. 2022-01-25. Dostupné online. (po anglicky)
- ↑ 2-Methylbenzyldimethylamine online. www.orgsyn.org, cit. 2022-01-25. Dostupné online. (po anglicky)
- ↑ Phenylmethylglycidic ester online. www.orgsyn.org, cit. 2022-01-25. Dostupné online. (po anglicky)
- ↑ 2-Methylindole online. www.orgsyn.org, cit. 2022-01-25. Dostupné online. (po anglicky)
- ↑ Peroxides and peroxide-forming compounds. Chemical Health and Safety, 2001, s. 12–22. ISSN 1074-9098. DOI: 10.1016/S1074-9098(01)00247-7.
- ↑ Sodium amide SOP online. Princeton. Dostupné online.
Zdrojupraviť | upraviť zdroj
Tento článok je čiastočný alebo úplný preklad článku Sodium amide na anglickej Wikipédii.
Text je dostupný za podmienok Creative Commons Attribution/Share-Alike License 3.0 Unported; prípadne za ďalších podmienok. Podrobnejšie informácie nájdete na stránke Podmienky použitia.
Antropológia
Aplikované vedy
Bibliometria
Dejiny vedy
Encyklopédie
Filozofia vedy
Forenzné vedy
Humanitné vedy
Knižničná veda
Kryogenika
Kryptológia
Kulturológia
Literárna veda
Medzidisciplinárne oblasti
Metódy kvantitatívnej analýzy
Metavedy
Metodika
Text je dostupný za podmienok Creative
Commons Attribution/Share-Alike License 3.0 Unported; prípadne za ďalších
podmienok.
Podrobnejšie informácie nájdete na stránke Podmienky
použitia.
www.astronomia.sk | www.biologia.sk | www.botanika.sk | www.dejiny.sk | www.economy.sk | www.elektrotechnika.sk | www.estetika.sk | www.farmakologia.sk | www.filozofia.sk | Fyzika | www.futurologia.sk | www.genetika.sk | www.chemia.sk | www.lingvistika.sk | www.politologia.sk | www.psychologia.sk | www.sexuologia.sk | www.sociologia.sk | www.veda.sk I www.zoologia.sk