
A | B | C | D | E | F | G | H | CH | I | J | K | L | M | N | O | P | Q | R | S | T | U | V | W | X | Y | Z | 0 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9
| Bromid fosforečný | |||||||||||||||||||||||||||||||||
 | |||||||||||||||||||||||||||||||||
 | |||||||||||||||||||||||||||||||||
| Všeobecné vlastnosti | |||||||||||||||||||||||||||||||||
| Sumárny vzorec | PBr5 | ||||||||||||||||||||||||||||||||
| Vzhľad | žltooranžový prášok alebo ihličky | ||||||||||||||||||||||||||||||||
| Fyzikálne vlastnosti | |||||||||||||||||||||||||||||||||
| Molekulová hmotnosť | 430,5 u | ||||||||||||||||||||||||||||||||
| Molárna hmotnosť | 430,494 g/mol | ||||||||||||||||||||||||||||||||
| Teplota rozkladu | 106 °C | ||||||||||||||||||||||||||||||||
| Hustota | 3,574 g/cm³ (−79 °C) | ||||||||||||||||||||||||||||||||
| Rozpustnosť | vo vode: prudko reaguje v polárnych rozpúšťadlách: reaguje s alkoholmy v nepolárnych rozpúšťadlách: kvapalné uhľovodíky étrery tetrachlórmetán (chlorid uhličitý) | ||||||||||||||||||||||||||||||||
| Termochemické vlastnosti | |||||||||||||||||||||||||||||||||
| Štandardná zlučovacia entalpia | −285 kJ/mol | ||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||
| Ďalšie informácie | |||||||||||||||||||||||||||||||||
| Číslo CAS | 7789-69-7 | ||||||||||||||||||||||||||||||||
| Číslo UN | 2691 | ||||||||||||||||||||||||||||||||
| EINECS číslo | 232-186-6 | ||||||||||||||||||||||||||||||||
| Pokiaľ je to možné a bežné, používame jednotky sústavy SI. Ak nie je hore uvedené inak, údaje sú za normálnych podmienok. | |||||||||||||||||||||||||||||||||
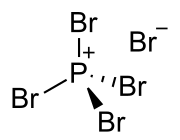
Bromid fosforečný (PBr5) je anorganická zlúčenina a jeden z bromidov fosforu. Za bežných podmienok ide o reaktívnu žltú tuhú látku. V tuhej fáze má štruktúru PBr4+Br-, v plynnej fáze je však úplne disociovaný na bromid fosforitý a bróm. Rýchle ochladenie tejto fázy na 15 kelvinov vedie k vytvoreniu iónov +-.
Bromid fosforečný je možné používať v organickej chémii v konverzii karboxylových kyselín na acylbromidy. Je to silná žieravina a je potrebné s ním zaobchádzať opatrne. Pri teplotách nad 100 °C sa rozkladá na bromid fosforitý a bróm:[1]
- PBr5 → PBr3 + Br2
Obrátenie tohto vzorca pre vytvorenie bromidu fosforečného adíciou brómu s bromidom fosforitým je v praxi ťažké, pretože výsledný produkt je náchylný na ďalšiu adíciu (vzniká tribromid tetrabrómfosfónia Br3).[2]
Referencie
- ↑ Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements, 2nd, Oxford:Butterworth-Heinemann. ISBN 0080379419
- ↑ „Spectrophotometric Study of Phosphorus Pentabromide in Various Solvents“(1954). J. Am. Chem. Soc.76(15): 3916–3919. doi:10.1021/ja01644a014
Literatúra
- VOHLÍDAL, Jiří; ŠTULÍK, Karel; JULÁK, Alois. Chemické a analytické tabuľky. 1. vyd. Praha : Grada Publishing, 1999. ISBN 80-7169-855-5.
Zdroj
Tento článok je čiastočný alebo úplný preklad článku Bromid fosforečný na českej Wikipédii.
Text je dostupný za podmienok Creative Commons Attribution/Share-Alike License 3.0 Unported; prípadne za ďalších podmienok. Podrobnejšie informácie nájdete na stránke Podmienky použitia.
Antropológia
Aplikované vedy
Bibliometria
Dejiny vedy
Encyklopédie
Filozofia vedy
Forenzné vedy
Humanitné vedy
Knižničná veda
Kryogenika
Kryptológia
Kulturológia
Literárna veda
Medzidisciplinárne oblasti
Metódy kvantitatívnej analýzy
Metavedy
Metodika
Text je dostupný za podmienok Creative
Commons Attribution/Share-Alike License 3.0 Unported; prípadne za ďalších
podmienok.
Podrobnejšie informácie nájdete na stránke Podmienky
použitia.
www.astronomia.sk | www.biologia.sk | www.botanika.sk | www.dejiny.sk | www.economy.sk | www.elektrotechnika.sk | www.estetika.sk | www.farmakologia.sk | www.filozofia.sk | Fyzika | www.futurologia.sk | www.genetika.sk | www.chemia.sk | www.lingvistika.sk | www.politologia.sk | www.psychologia.sk | www.sexuologia.sk | www.sociologia.sk | www.veda.sk I www.zoologia.sk


