A | B | C | D | E | F | G | H | CH | I | J | K | L | M | N | O | P | Q | R | S | T | U | V | W | X | Y | Z | 0 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9
| Furán | |
 | |
| Všeobecné vlastnosti | |
| Sumárny vzorec | C4H4O |
| Systematický názov | Furán |
| Vzhľad | bezfarebná kvapalina |
| Fyzikálne vlastnosti | |
| Molárna hmotnosť | 68,07 g/mol |
| Teplota topenia | −85,6 °C |
| Teplota varu | 31,4 °C |
| Hustota | 0,936 g/cm3 |
| pKA | 35,6[1] |
| Ďalšie informácie | |
| Číslo CAS | 110-00-9 |
| Pokiaľ je to možné a bežné, používame jednotky sústavy SI. Ak nie je hore uvedené inak, údaje sú za normálnych podmienok. | |
Furán je heterocyklická organická zlúčenina s jedným atómom kyslíka v päťčlánkovom cykle. Je to aromatická zlúčenina. Za normálnych podmienok je to priehľadná, veľmi prchavá, horľavá kvapalina s teplotou varu blízkej izbovej teplote (31,4 °C).
Furán je toxický a karcinogénny. Jeho katalytickou hydrogenáciou v prítomnosti paládia vzniká tetrahydrofurán. V kyslom prostredí je nestabilný a polymerizuje.[2]
Syntéza
Bežne sa furán pripravuje Feistovou-Benaryho syntézou. Ide o reakciu α-halogénketónov s β-dikarbonylovými zlúčeninami. Vyjadruje ju nasledovná schéma:

Veľmi jednoduchý spôsob výroby furánu je reakcia 1,4-diketónov s oxidom fosforečným podľa Paalovej-Knorrovej syntézy.
Reakcie
Kvôli jeho aromatickosti reaguje furán veľmi odlišne od ostatných heterocyklických éterov, ako je tetrahydrofurán. V elektrofilných substitučných reakciách je podstatne reaktívnejší ako benzén. Substituenty sa prednostne naväzujú do polôh 2 a 5.
Furán môže vstupovať do Dielsovej-Alderovej reakcie, napríklad:

Furán možno katalyticky v prítomnosti paládia hydrogenovať na dihydrofurán a tetrahydrofurán.
Biochemický význam
Podľa furánu sú pomenované furanózy, cyklické formy sacharidov, ktoré majú päť atómov v kruhu. Furanózy však nemajú aromatický kruh a ich základom je v skutočnosti tetrahydrofurán.
Podobné zlúčeniny
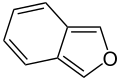
Látky obsahujúce furánový cyklus
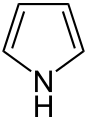
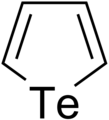
Analógy furánu
Iné podobné zlúčeniny
Referencie
- ↑ BARAN, Phil. Essentials of Heterocyclic Chemistry-I . . Dostupné online.
- ↑ furán. In: BÍNA, Jaroslav. Malá encyklopédia chémie. Bratislava : Obzor, 1981. S. 268.
Text je dostupný za podmienok Creative Commons Attribution/Share-Alike License 3.0 Unported; prípadne za ďalších podmienok. Podrobnejšie informácie nájdete na stránke Podmienky použitia.
Antropológia
Aplikované vedy
Bibliometria
Dejiny vedy
Encyklopédie
Filozofia vedy
Forenzné vedy
Humanitné vedy
Knižničná veda
Kryogenika
Kryptológia
Kulturológia
Literárna veda
Medzidisciplinárne oblasti
Metódy kvantitatívnej analýzy
Metavedy
Metodika
Text je dostupný za podmienok Creative
Commons Attribution/Share-Alike License 3.0 Unported; prípadne za ďalších
podmienok.
Podrobnejšie informácie nájdete na stránke Podmienky
použitia.
www.astronomia.sk | www.biologia.sk | www.botanika.sk | www.dejiny.sk | www.economy.sk | www.elektrotechnika.sk | www.estetika.sk | www.farmakologia.sk | www.filozofia.sk | Fyzika | www.futurologia.sk | www.genetika.sk | www.chemia.sk | www.lingvistika.sk | www.politologia.sk | www.psychologia.sk | www.sexuologia.sk | www.sociologia.sk | www.veda.sk I www.zoologia.sk