
A | B | C | D | E | F | G | H | CH | I | J | K | L | M | N | O | P | Q | R | S | T | U | V | W | X | Y | Z | 0 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9
| Plutonium | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ↓ Periodická tabulka ↓ | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
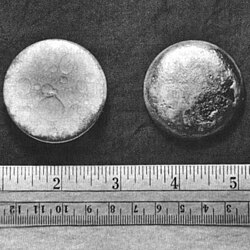
Malé kousky plutonia focené vůči pravítku s palcovou a centimetrovou škálou | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Obecné | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Název, značka, číslo | Plutonium, Pu, 94 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Cizojazyčné názvy | lat. Plutonium | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Skupina, perioda, blok | 7. perioda, blok f | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Chemická skupina | Aktinoidy | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Koncentrace v zemské kůře | 2×10−15 ppm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Vzhled | stříbrobílý kov | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Identifikace | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Registrační číslo CAS | 7440-07-5 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomové vlastnosti | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Relativní atomová hmotnost | 244,064 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomový poloměr | 150 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kovalentní poloměr | 162 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Iontový poloměr | (Pu3+) 108 pm (Pu4+) 93 pm (Pu5+) 80 pm (Pu6+) 73 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronová konfigurace | 5f6 7s2 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Oxidační čísla | III, IV, V, VI, VII, VIII[1] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronegativita (Paulingova stupnice) | 1,28 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ionizační energie | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| První | 5,5 eV | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Druhá | 13,0 eV | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Třetí | 23,5 eV | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Čtvrtá | 39,5 eV | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Látkové vlastnosti | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Krystalografická soustava | α-modifikace jednoklonná β-modifikace jednoklonná tělesně centrovaná γ-modifikace kosočtverečná plošně centrovaná δ-modifikace krychlová plošně centrovaná δ´-modifikace čtverečná tělesně centrovaná ε-modifikace krychlová tělesně centrovaná | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Molární objem | 12,29×10−6 m3/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Teplota změny modifikace | 122 °C (α → β) 203 °C (β → γ) 317 °C (γ → δ) 453 °C (δ → δ´) 477 °C (δ´ → ε) °C (395,15 K) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Mechanické vlastnosti | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Hustota | 19,816 g/cm3 (mod. α, 21 °C) 17,77 g/cm3 (mod. β, 150 °C) 17,19 g/cm3 (mod. γ, 210 °C) 15,92 g/cm3 (mod. δ, 320 °C) 15,99 g/cm3 (mod. δ´, 465 °C) 16,48 g/cm3 (mod. ε, 500 °C) 16,185 g/cm3 (950 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Skupenství | pevné | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Povrchové napětí | 550 ± 55 mN/m (při tt) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Rychlost zvuku | 2 260 m/s | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Termické vlastnosti | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Tepelná vodivost | (0 °C) 6,16 W m−1 K−1 (25 °C) 6,70 W m−1 K−1 (77 °C) 7,90 W⋅m−1⋅K−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Součinitel délkové roztažnosti | 54×10−6 K−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Molární atomizační entalpie | 364,4 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Standardní molární entropie S° | 51,5 J K−1 mol−1 (mod. α) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Termodynamické vlastnosti | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Teplota tání | 641 °C (914,15 K) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Teplota varu | 3 232 °C (3 505,15 K) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Specifické teplo tání | 2,828 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Specifické teplo varu | 333,5 kJ/mol (1 320 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Entalpie změny modifikace ΔHα→β | 3,77 kJ/mol (α → β) 0,669 kJ/mol (β → γ) 0,619 kJ/mol (γ → δ) 0,042 kJ/mol (δ → δ´) 1,858 kJ/mol (δ´ → ε) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Molární tepelná kapacita | 36,99 J K−1 mol−1 (α mod., 67 °C) 34,31 J K−1 mol−1 (β mod., 200 °C) 37,02 J K−1 mol−1 (γ mod., 270 °C) 37,66 J K−1 mol−1 (δ mod.) 35,1 J K−1 mol−1 (ε mod.) 41,8 J K−1 mol−1 (kapalina, 675 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektromagnetické vlastnosti | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Měrný elektrický odpor | 141,4×10−8 Ω m (107 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Teplota přechodu do supravodivého stavu | 0,5 K | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Standardní elektrodový potenciál | (Pu3+ → Pu0) -2,031 V (Pu4+ → Pu3+) 1,006 V (Pu5+ → Pu4+) 1,099 V | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Magnetické chování | paramagnetický | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Měrná magnetická susceptibilita | 2,52×10−6 cm3/g (20 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Bezpečnost | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 Radioaktivní | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Není-li uvedeno jinak, jsou použity jednotky SI a STP (25 °C, 100 kPa). | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Plutonium (chemická značka Pu) je šestý člen z řady aktinoidů, druhý transuran, radioaktivní, řetězovou reakcí štěpitelný, toxický kovový prvek, připravovaný uměle bombardováním uranu v jaderných reaktorech, především pro výrobu jaderných bomb. Je využitelné rovněž jako palivo pro jaderné reaktory a jako zdroj energie pro radioizotopový termoelektrický generátor.
Základní fyzikálně-chemické vlastnosti

Plutonium je radioaktivní kovový prvek stříbřitě bílé barvy, která se působením vzdušného kyslíku mění na šedavou. Čisté plutonium je podobně jako uran ve formě hoblin a pilin samozápalné, proto jeho zpracování vyžaduje extrémní opatrnost.
Ve sloučeninách se vyskytuje v mocenství od Pu+3 po Pu+7[1], přičemž stálejší jsou sloučeniny s nižší valencí. Soli plutonia vykazují v roztoku rozdílné zabarvení podle mocenství plutoniového iontu. Nejběžnější oxidační číslo plutonia je +IV a v tomto oxidační stupni vytváří plutonium amfoterní oxid plutoničitý PuO2. To znamená, že tento oxid se v roztocích kyselin rozpouští za vzniku plutoničitých solí a v zásadách za vzniku komplexního aniontu a vytváří plutoničitany. Plutoničité soli nejsou v roztocích úplně stabilní a částečně nebo úplně hydrolyzují, to je možno potlačit snížením pH (přidáním kyseliny) do roztoku.
Čistý kov lze připravit redukcí fluoridu plutonia kovovým lithiem nebo baryem při teplotě kolem 1200 °C.
Historie objevu
Plutonium bylo poprvé připraveno roku 1940 dvěma vědeckými týmy bombardováním 238U neutrony. V jaderné laboratoři v Berkeley na kalifornské univerzitě ho připravili Edwin M. McMillan a Philip Abelson a v britské Cambridgi ohlásili jeho přípravu Norman Feather a Egon Bretscher.
Příprava a izolace čistého kovu se uskutečnila 23. února 1941 v Berkeley bombardováním uranu jádry deuteria v cyklotronu. Jako autoři tohoto experimentu jsou označováni Glenn T. Seaborg, Edwin McMillan, J. W. Kennedy a A. C. Wahl. Vzhledem k probíhající druhé světové válce byly výsledky tohoto bádání udržovány v tajnosti, zvláště proto, že jedna ze dvou atomových bomb svržených USA na Japonsko byla vyrobena právě z plutonia.
Výskyt a izotopy
Plutonium patří mezi uměle připravené prvky a v přírodě je možné se setkat jen se skutečně ultrastopovými množstvími v uranových rudách, kde mohou jednotlivé atomy vzniknout z 238U po záchytu neutronu a následných dvou rozpadech β.
Mezi 20 známými izotopy plutonia existuje několik, které vykazují dostatečně velký poločas rozpadu, aby je bylo možno prakticky využít. Nejdelší poločas (asi 80 milionů let) má 244Pu, nejdůležitější izotop 239Pu se rozpadá s poločasem 24 110 let, 240Pu 6561 let, 241Pu 14,325 roků, 242Pu 375 000 let a 238Pu má poločas rozpadu 87,7 let; existuje však celá řada dalších izotopů:
| Izotop | poločas rozpadu | druh rozpadu | produkt rozpadu |
|---|---|---|---|
| 228Pu | 1,1 s | α | 224U |
| 229Pu | 67 s | α (50 %) / ε (50 %) | 225U / 229Np |
| 230Pu | 102 s | α | 226U |
| 231Pu | 8,6 min | ε (90 %) / α (10 %) | 231Np / 227U |
| 232Pu | 33,8 min | ε (90 %) / α (10 %) | 232Np / 228U |
| 233Pu | 20,9 min | ε (99,88 %) / α (0,12 %) | 233Np / 229U |
| 234Pu | 8,8 h | ε (94 %) / α (6 %) | 234Np / 230U |
| 235Pu | 25,3 min | ε (100,00 %) / α (2,8×10−3 %) | 235Np / 231U |
| 236Pu | 2,858 r | α (100 %) / SF (1,9×10−7 %) | 232U / různé |
| 237Pu | 45,64 d | ε (100,00 %) / α (4,2×10−3 %) | 237Np/ 233U |
| 238Pu | 87,7 r | α (100 %) / SF (1,9×10−7 %) | 234U / různé |
| 239Pu | 24 110 r | α / SF (3×10−10 %) | 235U / různé |
| 240Pu | 6 561 r | α / SF (5,7×10−6 %) | 236U / různé |
| 241Pu | 14,329 r | β− (100,00 %)/ α (2,5×10−3 %) SF (<2×10−14 %) |
241Am / 237U / různé |
| 242Pu | 375 000 r | α (100 %)/ SF (5,5×10−4 %) | 238U / různé |
| 243Pu | 4,956 h | β− | 243Am |
| 244Pu | 8×107 r | α (99,88 %) / SF (0,12 %) | 240U / různé |
| 245Pu | 10,5 h | β− | 245Am |
| 246Pu | 10,84 d | Zdroj:https://cs.wikipedia.org?pojem=Plutonium
