
A | B | C | D | E | F | G | H | CH | I | J | K | L | M | N | O | P | Q | R | S | T | U | V | W | X | Y | Z | 0 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9
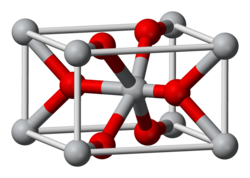
| Oxid manganičitý | |||||||||||||||||||||||||||||||||||||
 | |||||||||||||||||||||||||||||||||||||
 | |||||||||||||||||||||||||||||||||||||
| Všeobecné vlastnosti | |||||||||||||||||||||||||||||||||||||
| Sumárny vzorec | MnO2 | ||||||||||||||||||||||||||||||||||||
| Synonymá | Burel | ||||||||||||||||||||||||||||||||||||
| Vzhľad | Hnedočierna práškovitá látka | ||||||||||||||||||||||||||||||||||||
| Fyzikálne vlastnosti | |||||||||||||||||||||||||||||||||||||
| Molekulová hmotnosť | 87,0 u | ||||||||||||||||||||||||||||||||||||
| Molárna hmotnosť | 86,937 g/mol | ||||||||||||||||||||||||||||||||||||
| Teplota rozkladu | 535 °C | ||||||||||||||||||||||||||||||||||||
| Hustota | 5,03 – 5,08 g/cm³ | ||||||||||||||||||||||||||||||||||||
| Rozpustnosť | vo vode: nerozpustný v polárnych rozpúšťadlách: kyselina chlorovodíková kyselina sírová kyselina dusičná (nerozpustný) | ||||||||||||||||||||||||||||||||||||
| Teplota vzplanutia | 535 °C | ||||||||||||||||||||||||||||||||||||
| Termochemické vlastnosti | |||||||||||||||||||||||||||||||||||||
| Štandardná zlučovacia entalpia | −520,9 kJ/mol | ||||||||||||||||||||||||||||||||||||
| Štandardná entropia | 53,1 J K−1 mol−1 | ||||||||||||||||||||||||||||||||||||
| Štandardná Gibbsová energia | −466,0 kJ/mol | ||||||||||||||||||||||||||||||||||||
| Merná tepelná kapacita | 0,623 J K−1 g−1 | ||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||
| Ďalšie informácie | |||||||||||||||||||||||||||||||||||||
| Číslo CAS | 1313-13-9 | ||||||||||||||||||||||||||||||||||||
| Číslo UN | 1479 | ||||||||||||||||||||||||||||||||||||
| EINECS číslo | 215-202-6 | ||||||||||||||||||||||||||||||||||||
| Číslo RTECS | OP0350000 | ||||||||||||||||||||||||||||||||||||
| Pokiaľ je to možné a bežné, používame jednotky sústavy SI. Ak nie je hore uvedené inak, údaje sú za normálnych podmienok. | |||||||||||||||||||||||||||||||||||||
Oxid manganičitý je jedným z oxidov mangánu. V prírode sa vyskytuje ako černastý alebo hnedý minerál pyroluzit. Čistý oxid manganičitý je čierna práškovitá látka s výraznými redoxnými schopnosťami, nerozpustný vo vode ani v kyseline dusičnej. Je dobre rozpustný v kyseline chlorovodíkovej za studena a za tepla v kyseline sírovej a hydroxide draselnom.
Fyzikálno-chemické vlastnosti
Oxid manganičitý sa pri teplote 535 °C rozkladá za vzniku oxidu manganitého a kyslíka. Pri teplotách blízkych 1000 °C pokračuje rozklad na podvojnú zlúčeninu oxid manganato-manganitého. Pri ešte vyšších teplotách pokračuje rozklad na oxid manganatý.
- 4 MnO2 t → 2 Mn2O3 + O2
- 6 Mn2O3 t → 4 Mn3O4 + O2
- 2 Mn3O4 t → 6 MnO + O2
Oxid manganičitý má silné redukčné aj oxidačné schopnosti. Pôsobením kyseliny chlorovodíkovej dochádza k jeho redukcii za vzniku manganatej soli a chlóru (túto reakciu využil Carl Wilhelm Scheele k prvej izolácii chlóru v roku 1774):
- MnO2 + 4 HCl → MnCl2 + Cl2 + 2 H2O
Pri pôsobení horúcej kyseliny sírovej na oxid manganičitý dochádza k uvoľneniu kyslíka:
- 2 MnO2 + 2 H2SO4 → 2 MnSO4 + O2 + 2 H2O
Zahriatím hydroxidu draselného s oxidom manganičitým a za prebublávania vzduchu dochádza k oxidácii na manganan draselný, ktorý ďalej samovoľne prechádza na manganistan draselný (vďaka oxidu uhličitému vo vzduchu) a vzniknutý oxid manganičitý ďalej reaguje opäť za vzniku mangananu:
- 2 MnO2 + 4 KOH + O2 → 2 K2MnO4 + 2 H2O
- 3 K2MnO4 + 2 CO2 → 2 KMnO4 + 2 K2CO3 + MnO2
Využitie
Redukčné schopnosti sa využívajú pri výrobe manganistanu draselného. Oxidačné schopnosti sa využívali pri výrobe chlóru, horúca kyselina chlorovodíková sa liala na pyroluzit a uvoľňoval sa chlór. Používa sa v alkalických batériách a zinkovo-uhlíkových článkoch v zmesi s uhlíkom ako depolarizačné činidlo, aby sa zabránilo prebíjaniu batérie naprázdno.[1]
Oxid manganičitý sa v laboratóriách využíva na katalyzovaný rozklad peroxidu vodíka na vodu a kyslík:
- 2H2O2 → 2H2O + O2
V organickej syntéze sa využíva k oxidácii allylických alkoholov na príslušné aldehydy alebo ketóny.
- cis-RCH=CHCH2OH + MnO2 → cis-RCH=CHCHO + „MnO“ + H2O
Podobné látky
- Sulfid manganičitý
- Oxid rénatý
- Oxid techničitý
- Oxid manganato-manganitý
- Oxid manganatý
- Oxid manganistý
- Oxid manganitý
Referencie
- ↑ Norman Neil Greenwood, Alan Earnshaw, Chemistry of the Elements, 1nd ed., Butterworth-Heinemann, Oxford : Pergamon, UK, 1997, pp. 1218–20, ISBN 0-08-022057-6.
Pozri aj
Literatúra
- VOHLÍDAL, Jiří; ŠTULÍK, Karel; JULÁK, Alois. Chemické a analytické tabuľky. 1. vyd. Praha : Grada Publishing, 1999. ISBN 80-7169-855-5.
Zdroj
Tento článok je čiastočný alebo úplný preklad článku Oxid manganičitý na českej Wikipédii.
Text je dostupný za podmienok Creative Commons Attribution/Share-Alike License 3.0 Unported; prípadne za ďalších podmienok. Podrobnejšie informácie nájdete na stránke Podmienky použitia.
Antropológia
Aplikované vedy
Bibliometria
Dejiny vedy
Encyklopédie
Filozofia vedy
Forenzné vedy
Humanitné vedy
Knižničná veda
Kryogenika
Kryptológia
Kulturológia
Literárna veda
Medzidisciplinárne oblasti
Metódy kvantitatívnej analýzy
Metavedy
Metodika
Text je dostupný za podmienok Creative
Commons Attribution/Share-Alike License 3.0 Unported; prípadne za ďalších
podmienok.
Podrobnejšie informácie nájdete na stránke Podmienky
použitia.
www.astronomia.sk | www.biologia.sk | www.botanika.sk | www.dejiny.sk | www.economy.sk | www.elektrotechnika.sk | www.estetika.sk | www.farmakologia.sk | www.filozofia.sk | Fyzika | www.futurologia.sk | www.genetika.sk | www.chemia.sk | www.lingvistika.sk | www.politologia.sk | www.psychologia.sk | www.sexuologia.sk | www.sociologia.sk | www.veda.sk I www.zoologia.sk





