A | B | C | D | E | F | G | H | CH | I | J | K | L | M | N | O | P | Q | R | S | T | U | V | W | X | Y | Z | 0 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9
| Fosfán | |||||||||||||||||||||||||||||||||||||||||
| Všeobecné vlastnosti | |||||||||||||||||||||||||||||||||||||||||
| Sumárny vzorec | PH3 | ||||||||||||||||||||||||||||||||||||||||
| Synonymá | Fosfín | ||||||||||||||||||||||||||||||||||||||||
| Vzhľad | Bezfarebný plyn | ||||||||||||||||||||||||||||||||||||||||
| Fyzikálne vlastnosti | |||||||||||||||||||||||||||||||||||||||||
| Molekulová hmotnosť | 34,0 u | ||||||||||||||||||||||||||||||||||||||||
| Molárna hmotnosť | 33,998 g/mol | ||||||||||||||||||||||||||||||||||||||||
| Teplota topenia | -133,5 °C | ||||||||||||||||||||||||||||||||||||||||
| Teplota varu | -87,43 °C | ||||||||||||||||||||||||||||||||||||||||
| Kritický bod | Teplota: 51,3 °C Tlak: 6 510 kPa | ||||||||||||||||||||||||||||||||||||||||
| Hustota | 0,001 529 g/cm³ (0 °C) 0,746 g/cm³ (-90 °C) 0,896 g/cm³ (-135 °C) | ||||||||||||||||||||||||||||||||||||||||
| Rozpustnosť | vo vode: 33 mg/100 ml (20 °C) v polárnych rozpúšťadlách: etanol dietyléter v nepolárnych rozpúšťadlách: aromatické uhľovodíky | ||||||||||||||||||||||||||||||||||||||||
| Teplota vzplanutia | 38 °C | ||||||||||||||||||||||||||||||||||||||||
| Termochemické vlastnosti | |||||||||||||||||||||||||||||||||||||||||
| Entropia topenia | 33,2 J/g | ||||||||||||||||||||||||||||||||||||||||
| Entropia varu | 429,7 J/g | ||||||||||||||||||||||||||||||||||||||||
| Štandardná zlučovacia entalpia | 9,25 kJ/mol | ||||||||||||||||||||||||||||||||||||||||
| Štandardná entropia | 210,2 J K-1 mol-1 | ||||||||||||||||||||||||||||||||||||||||
| Štandardná Gibbsová energia | 13,4 kJ/mol | ||||||||||||||||||||||||||||||||||||||||
| Merná tepelná kapacita | 1,091 J K-1 g-1 | ||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||
| Ďalšie informácie | |||||||||||||||||||||||||||||||||||||||||
| Číslo CAS | 7803-51-2 | ||||||||||||||||||||||||||||||||||||||||
| EINECS číslo | 232-260-8 | ||||||||||||||||||||||||||||||||||||||||
| Číslo RTECS | SY7525000 | ||||||||||||||||||||||||||||||||||||||||
| Pokiaľ je to možné a bežné, používame jednotky sústavy SI. Ak nie je hore uvedené inak, údaje sú za normálnych podmienok. | |||||||||||||||||||||||||||||||||||||||||
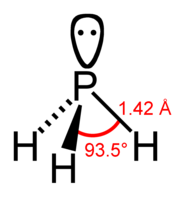
Fosfán (PH3) je hydrid fosforu. Molekula má tvar pyramídy s uhlom HPH = 93,5 °. Čistý fosfán nie je samovznietivý ale v prítomnosti stôp difosfánu P2H4 alebo pár bieleho fosforu P4, sa vznecuje. Zapálený sa oxiduje vzduchom a môže tvoriť explózivné zmesi. Je veľmi jedovatý. Na rozdiel od amoniaku NH3 nie je v kvapalnom stave asociovaný a je len nepatrne rozpustný vo vode. Roztoky nie sú ani kyslé ani zásadité. Reaguje však s niektorými kyselinami za vzniku fosfoniových solí.
- PH3 + HI ⇒ PH4I
Fosfán je tiež silným redukčným činidlom a reaguje s roztokmi mnohých kovových iónov za vzniku fosfidov. V zásaditom roztoku prebieha reakcia:
- P + 3 H2O + 3 e ⇒ PH3 + 3 OH-.
Čistý plyn je bez zápachu, typický zápach technického fosfánu po rybine alebo cesnaku je spôsobený nečistotami.[1]
Toxicita
Hlavná vstupná cesta do organizmu je vdychovanie plynného fosfánu. Pri požití kovových fosfidov (najmä hliníka a zinku) dochádza v tráviacom trakte k hydrolýze a uvoľneniu fosfánu. Vdychovanie plynu spôsobuje silné podráždenie pľúc, ich edém, srdcovú dysfunkciu, excitáciu CNS, kómu, prípadne smrť. Objavujú sa tiež zažívacie ťažkosti, poškodenie obličiek a leukopénia.[1]
Po požití fosfidov sa objavuje podráždenie vedúce až ku krvácaniu, obehový kolaps, neuropsychiatrické problémy, zlyhanie dýchacích funkcií a obličiek. Neskôr sa môže objaviť poškodenie pečene. Bol publikovaný rad správ o vysokej mortalite (nad 50%) u otráv fosfidmi v Indii.[1] Fosfid zinku sa skôr používal ako rodenticíd.
K smrti pri otrave dochádza obvykle do štyroch dní, ale môže k nej dôjsť za jeden alebo dva týždne. Posmrtné analýzy ukázali infiltráciu a nekrózu srdcového svalu, pľúcny edém a poškodenie malých ciev.[1]
Chronická expozícia spôsobuje bolesti zubov, opuch až nekrózu čeľuste, slabosť, stratu váhy, anémiu a samovoľné zlomeniny.[1]
Fosfán sa z tela vylučuje jednak nezmenený vo vydychovanom vzduchu, a ďalej tiež močom v podobe fosfornanov a fosforitanov. Oxidácia fosfánu v tele je pomalá. Denaturuje oxyhemoglobín a inhibuje radu enzýmov.[1]
Boli zaznamenané prípady smrteľných otráv už pri koncentrácii fosfánu 1,2mg/m³. Pri požití fosfidu zinku nastala smrť už pri dávke 4,5g, naopak bolo hlásených prežitie i u dávky 50g.[1]
U králikov sa pri koncentrácii 70 mg/m³ po dobu 10 minút neobjavili žiadne príznaky, ale expozícia koncentrácii 140 mg/m³ bola smrteľná počas 2,5 – 3 hodín a pri koncentrácii 700 mg/m³ nastala smrť za 25 – 30 minút. Pri podávaní fosfidu zinku potkanom uhynulo 1 z 12 zvierat pri 200 mg/kg a pri 500 mg/kg 10 z 12 zvierat. Dávka 100 mg/kg a menej nebola smrteľná, ale bol pozorovaný úbytok hemoglobínu a červených krviniek.[1]
Podobné látky
Referencie
- ↑ a b c d e f g h Phosphine - International Programme on Chemical Safety - Poisons Information Monograph 865
Literatúra
- VOHLÍDAL, Jiří; ŠTULÍK, Karel; JULÁK, Alois. Chemické a analytické tabuľky. 1. vyd. Praha : Grada Publishing, 1999. ISBN 80-7169-855-5.
Zdroj
Tento článok je čiastočný alebo úplný preklad článku Fosfan na českej Wikipédii.
Text je dostupný za podmienok Creative Commons Attribution/Share-Alike License 3.0 Unported; prípadne za ďalších podmienok. Podrobnejšie informácie nájdete na stránke Podmienky použitia.
Antropológia
Aplikované vedy
Bibliometria
Dejiny vedy
Encyklopédie
Filozofia vedy
Forenzné vedy
Humanitné vedy
Knižničná veda
Kryogenika
Kryptológia
Kulturológia
Literárna veda
Medzidisciplinárne oblasti
Metódy kvantitatívnej analýzy
Metavedy
Metodika
Text je dostupný za podmienok Creative
Commons Attribution/Share-Alike License 3.0 Unported; prípadne za ďalších
podmienok.
Podrobnejšie informácie nájdete na stránke Podmienky
použitia.
www.astronomia.sk | www.biologia.sk | www.botanika.sk | www.dejiny.sk | www.economy.sk | www.elektrotechnika.sk | www.estetika.sk | www.farmakologia.sk | www.filozofia.sk | Fyzika | www.futurologia.sk | www.genetika.sk | www.chemia.sk | www.lingvistika.sk | www.politologia.sk | www.psychologia.sk | www.sexuologia.sk | www.sociologia.sk | www.veda.sk I www.zoologia.sk