A | B | C | D | E | F | G | H | CH | I | J | K | L | M | N | O | P | Q | R | S | T | U | V | W | X | Y | Z | 0 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9
| Chlorid kobaltnatû§ | |||||||||||||||||||||||||||||||||||||||
| VéÀeobecnûˋ vlastnosti | |||||||||||||||||||||||||||||||||||||||
| SumûÀrny vzorec | CoCl2 | ||||||||||||||||||||||||||||||||||||||
| Vzháƒad | svetlomodrû§ prûÀéÀok (bezvodû§) fialovûˋ kryéÀtûÀly (dihydrûÀt) áervenûˋ kryéÀtûÀly (hexahydrûÀt) | ||||||||||||||||||||||||||||||||||||||
| FyzikûÀlne vlastnosti | |||||||||||||||||||||||||||||||||||||||
| MolekulovûÀ hmotnoséË | 129,8 u (bezvodû§) 165,9 u (dihydrûÀt) 237,9 u (hexahydrûÀt) | ||||||||||||||||||||||||||||||||||||||
| MolûÀrna hmotnoséË | 129,839 g/mol (bezvodû§) 165,870 g/mol (dihydrûÀt) 237,931 g/mol (hexahydrûÀt) | ||||||||||||||||||||||||||||||||||||||
| Teplota topenia | 730 ô¯C | ||||||||||||||||||||||||||||||||||||||
| Teplota varu | 1 050 ô¯C | ||||||||||||||||||||||||||||||||||||||
| Teplota sublimûÀcie | 500 ô¯C | ||||||||||||||||||||||||||||||||||||||
| Hustota | 3,348 g/cmô° (bezvodû§) 2,508 g/cmô° (dihydrûÀt) 1,918 g/cmô° (hexahydrûÀt) | ||||||||||||||||||||||||||||||||||||||
| RozpustnoséË | vo vode: bezvodû§ 43,5 g/100 ml (0 ô¯C) 47,7 g/100 ml (10 ô¯C) 52,9 g/100 ml (20 ô¯C) 56,2 g/100 ml (25 ô¯C) 59,7 g/100 ml (30 ô¯C) 69,5 g/100 ml (40 ô¯C) 93,8 g/100 ml (60 ô¯C) 97,6 g/100 ml (80 ô¯C) 106,2 g/100 ml (100 ô¯C) dihydrûÀt 162,19 g/100 ml (60 ô¯C) 165,23 g/100 ml (70 ô¯C) 192,17 g/100 ml (100 ô¯C) hexahydrûÀt 126,46 g/100 ml (0 ô¯C) 171,03 g/100 ml (20 ô¯C) 317,4 g/100 ml (40 ô¯C) 672,5 g/100 ml (60 ô¯C) 1 430 g/100 ml (100 ô¯C) v polûÀrnych rozpû¤éÀéËadlûÀch: metanol 38,5 g/100 ml (20 ô¯C) 58,2 g/100 ml (40 ô¯C) etanol 44,9 g/100 ml (0 ô¯C) 54,4 g/100 ml (20 ô¯C) 67,4 g/100 ml (40 ô¯C) acetû°n 9,3 g/100 ml (22,5 ô¯C) dietylûˋter 0,021 g/100 ml (25 ô¯C) | ||||||||||||||||||||||||||||||||||||||
| Termochemickûˋ vlastnosti | |||||||||||||||||||||||||||||||||||||||
| Entropia topenia | 238 J/g | ||||||||||||||||||||||||||||||||||||||
| Entropia varu | 877 J/g | ||||||||||||||||||||||||||||||||||||||
| Entropia rozpû¤éÀéËania | ã622 J/g | ||||||||||||||||||||||||||||||||||||||
| é tandardnûÀ zluáovacia entalpia | ã325,5 kJ/mol (bezvodû§) -933,2 kJ/mol (dihydrûÀt) -2 346 kJ/mol (hexahydrûÀt) | ||||||||||||||||||||||||||||||||||||||
| é tandardnûÀ entropia | 106,3 J Kã1molã1 (bezvodû§) -2 019 J Kã1 molã1 (hexahydrûÀt) | ||||||||||||||||||||||||||||||||||||||
| é tandardnûÀ GibbsovûÀ energia | ã282,4 kJ/mol | ||||||||||||||||||||||||||||||||||||||
| MernûÀ tepelnûÀ kapacita | 0,606 J Kã1gã1 0,665 5 J Kã1 gã1 (200 ô¯C) | ||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||
| áaléÀie informûÀcie | |||||||||||||||||||||||||||||||||||||||
| áûÙslo CAS | 7646-79-9 (bezvodû§) 16544-92-6 (dihydrûÀt) 7791-13-1 (hexahydrûÀt) | ||||||||||||||||||||||||||||||||||||||
| áûÙslo UN | 3288 | ||||||||||||||||||||||||||||||||||||||
| EINECS áûÙslo | 231-589-4 | ||||||||||||||||||||||||||||||||||||||
| áûÙslo RTECS | GF9800000 | ||||||||||||||||||||||||||||||||||||||
| Pokiaრje to moéƒnûˋ a beéƒnûˋ, pouéƒûÙvame jednotky sû¤stavy SI. Ak nie je hore uvedenûˋ inak, û¤daje sû¤ za normûÀlnych podmienok. | |||||||||||||||||||||||||||||||||||||||
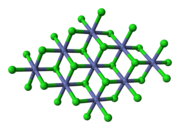
Chlorid kobaltnatû§ (CoCl2) je chemickûÀ lûÀtka, ktorûÀ mûÀ v bezvodom stave podobu silnûˋho hygroskopickûˋho bledomodrûˋho prûÀéÀku, ktorû§ postupnou hydratûÀciou prechûÀdza cez modrofialovû§, tmavo fialovû§, ruéƒovo fialovû§, broskyéovo fialovû§ aéƒ k áervenûˋmu hexahydrûÀtu. Tieto farebnûˋ prechody sa vyuéƒûÙvajû¤ v silikagûˋli, do ktorûˋho sa zlû¤áenina pridûÀva ako indikûÀtor mnoéƒstva obsiahnutej vlhkosti.
Je dobre rozpustnû§ vo vode, metanole, liehu, acetû°ne, dietylûˋteri, chinolûÙne a benzonitrile, vytvûÀra v roztoku podvojnûˋ aj komplexnûˋ zlû¤áeniny. HexahydrûÀt je navyéÀe rozpustnû§ v dimetylformamide (DMF), alkoholoch a pyridûÙne.
PouéƒûÙva sa naprûÙklad pre vû§robu áaléÀûÙch zlû¤áenûÙn kobaltu, ako prûÙsada do zmesûÙ na vû§robu pneumatûÙk alebo textilnû§ch farbûÙv. Slû¤éƒi ako inhibûÙtor korû°zie v zariadenûÙ na û¤pravu vody, ale aj v magnetoch alebo v indikûÀtoroch vlhkosti.[1]
Podobnûˋ lûÀtky
Galûˋria
Referencie
- ã Miroslav é uta: REACH: 7 nebezpeánû§ch chemikûÀliûÙ pridanû§ch na áiernu listinu, 26. jû¤na 2011
Zdroj
Tento álûÀnok je áiastoánû§ alebo û¤plnû§ preklad álûÀnku Chlorid kobaltnatû§ na áeskej Wikipûˋdii.
Text je dostupnû§ za podmienok Creative Commons Attribution/Share-Alike License 3.0 Unported; prûÙpadne za áaléÀûÙch podmienok. PodrobnejéÀie informûÀcie nûÀjdete na strûÀnke Podmienky pouéƒitia.
Antropolû°gia
Aplikovanûˋ vedy
Bibliometria
Dejiny vedy
Encyklopûˋdie
Filozofia vedy
Forenznûˋ vedy
Humanitnûˋ vedy
KniéƒniánûÀ veda
Kryogenika
Kryptolû°gia
Kulturolû°gia
LiterûÀrna veda
MedzidisciplinûÀrne oblasti
Metû°dy kvantitatûÙvnej analû§zy
Metavedy
Metodika
NûÀboéƒenstvo a veda
NûÀuánûÀ literatû¤ra
Podvody vo vede
PopularizûÀcia vedy
PotravinûÀrstvo
PrûÙrodnûˋ vedy
Pseudoveda
Scientometria
Spoloáenskûˋ vedy
Teû°rie
Teatrolû°gia
Technickûˋ vedy
Technika
Terminolû°gia
Umenie
Vû§skum
Veda a technika podáƒa éÀtûÀtu
Veda a technika podáƒa kontinentu
Veda a technika podáƒa roka
Veda v kozme
Vedci
VedeckûÀ literatû¤ra
Vedeckûˋ databûÀzy
Vedeckûˋ experimenty
Vedeckûˋ konferencie
Vedeckûˋ metû°dy
Vedeckûˋ ocenenia
Vedeckûˋ organizûÀcie
Vedeckûˋ parky
VedeckûÙ spisovatelia
VzdelûÀvanie
ZûÀhady
Text je dostupnû§ za podmienok Creative
Commons Attribution/Share-Alike License 3.0 Unported; prûÙpadne za ďaléÀûÙch
podmienok.
PodrobnejéÀie informûÀcie nûÀjdete na strûÀnke Podmienky
pouéƒitia.
www.astronomia.sk | www.biologia.sk | www.botanika.sk | www.dejiny.sk | www.economy.sk | www.elektrotechnika.sk | www.estetika.sk | www.farmakologia.sk | www.filozofia.sk | Fyzika | www.futurologia.sk | www.genetika.sk | www.chemia.sk | www.lingvistika.sk | www.politologia.sk | www.psychologia.sk | www.sexuologia.sk | www.sociologia.sk | www.veda.sk I www.zoologia.sk