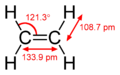A | B | C | D | E | F | G | H | CH | I | J | K | L | M | N | O | P | Q | R | S | T | U | V | W | X | Y | Z | 0 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9

Jako dvojná vazba se v chemii označuje chemická vazba mezi dvěma atomy, jíž se účastní čtyři vazebné elektrony namísto obvyklých dvou. Nejčastější dvojnou vazbu, mezi dvěma atomy uhlíku, lze nalézt v alkenech. Existuje mnoho typů dvojných vazeb mezi různými prvky; například v karbonylové skupině mezi atomem uhlíku a atomem kyslíku. Jinými hojně rozšířenými dvojnými vazbami jsou vazby v azosloučeninách (N=N), iminech (C=N) a sulfoxidech (S=O). Ve strukturních vzorcích se dvojná vazba znázorňuje dvěma rovnoběžnými čarami mezi atomy.[1] Mezi stejnými dvěma atomy je dvojná vazba obecně silnější a kratší než vazba jednoduchá. Pokud molekula obsahuje dvě nebo více dvojných vazeb, označujeme je podle polohy jako kumulované, konjugované nebo izolované.
- Běžné chemické sloučeniny s dvojnou vazbou
Princip dvojné vazby
Princip dvojné vazby se dá jednoduše vysvětlit pomocí hybridizace orbitalů. Například v ethenu má každý atom uhlíku tři sp2 orbitaly a jeden p-orbital. Tři sp2 orbitaly leží v jedné rovině se třemi 120° úhly mezi nimi. Nehybridizovaný p-orbital je kolmý k této rovině. Když se tyto dva atomy uhlíku přiblíží, jeden ze tří sp2 orbitalů na prvním uhlíku vytvoří σ vazbu s příslušným sp2 orbitalem na druhém uhlíku. Ve stejnou chvíli spolu výše zmíněné p-orbitaly vytvoří vazbu druhou (π vazbu). Kvůli maximálnímu překryvu orbitalů (silnější vazba) k sobě zůstávají p-orbitaly v rovnoběžné poloze, a proto není obecně možná rotace kolem dvojné vazby. Z této vlastnosti pramení cis- a trans- izomerie.

Odkazy
Reference
V tomto článku byl použit překlad textu z článku Double bond na anglické Wikipedii.
- ↑ Organic Chemistry 2nd Ed. John McMurry
Související články
Externí odkazy
 Obrázky, zvuky či videa k tématu dvojná vazba na Wikimedia Commons
Obrázky, zvuky či videa k tématu dvojná vazba na Wikimedia Commons
Text je dostupný za podmienok Creative Commons Attribution/Share-Alike License 3.0 Unported; prípadne za ďalších podmienok. Podrobnejšie informácie nájdete na stránke Podmienky použitia.
Antropológia
Aplikované vedy
Bibliometria
Dejiny vedy
Encyklopédie
Filozofia vedy
Forenzné vedy
Humanitné vedy
Knižničná veda
Kryogenika
Kryptológia
Kulturológia
Literárna veda
Medzidisciplinárne oblasti
Metódy kvantitatívnej analýzy
Metavedy
Metodika
Text je dostupný za podmienok Creative
Commons Attribution/Share-Alike License 3.0 Unported; prípadne za ďalších
podmienok.
Podrobnejšie informácie nájdete na stránke Podmienky
použitia.
www.astronomia.sk | www.biologia.sk | www.botanika.sk | www.dejiny.sk | www.economy.sk | www.elektrotechnika.sk | www.estetika.sk | www.farmakologia.sk | www.filozofia.sk | Fyzika | www.futurologia.sk | www.genetika.sk | www.chemia.sk | www.lingvistika.sk | www.politologia.sk | www.psychologia.sk | www.sexuologia.sk | www.sociologia.sk | www.veda.sk I www.zoologia.sk