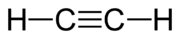A | B | C | D | E | F | G | H | CH | I | J | K | L | M | N | O | P | Q | R | S | T | U | V | W | X | Y | Z | 0 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9
| Etín | |||||||||||||
 | |||||||||||||
| Všeobecné vlastnosti | |||||||||||||
| Sumárny vzorec | C2H2 | ||||||||||||
| Synonymá | acetylén | ||||||||||||
| Vzhľad | bezfarebný plyn | ||||||||||||
| Fyzikálne vlastnosti | |||||||||||||
| Molekulová hmotnosť | 26,0373 g/mol | ||||||||||||
| Teplota topenia | -84 °C | ||||||||||||
| Teplota varu | -83,8 °C | ||||||||||||
| Kritický bod | 35,2 °C 6190 kPa | ||||||||||||
| Hustota | 1,09670 kg/m³ (plyn) | ||||||||||||
| Termochemické vlastnosti | |||||||||||||
| Štandardná zlučovacia entalpia | +226.88 kJ/mol | ||||||||||||
| |||||||||||||
| Ďalšie informácie | |||||||||||||
| Číslo CAS | 74-86-2 | ||||||||||||
| Pokiaľ je to možné a bežné, používame jednotky sústavy SI. Ak nie je hore uvedené inak, údaje sú za normálnych podmienok. | |||||||||||||
Acetylén (systematické pomenovanie etín) je chemická zlúčenina patriaca medzi uhľovodíky, konkrétne do skupiny alkínov.[1] Objavil ho v roku 1836 Ír Edmund Davy. Za normálnych podmienok je to plynná bezfarebná látka bez zápachu (technický acetylén má nepríjemný cesnakový zápach), ktorá so vzduchom vytvára vysoko výbušnú zmes.[1]
Výroba
Hydratáciou karbidu vápenatého
- Vstup: oxid vápenatý, uhlie (resp. koks)
- Výstup: karbid vápenatý, oxid uhoľnatý
- CaO + 3 C → CaC2 + CO
- Vstup: karbid vápenatý, voda;
- Výstup: acetylén, hydroxid vápenatý
- CaC2 + 2 H2O → Ca(OH)2 + C2H2 [1]
Produkcia plynu je 347 litrov na 1 kg karbidu vápenatého. Výhoda je v skladovateľnosti karbidu vápenatého a rýchlej produkcii acetylénu pri jeho hydratovaní.
Krakovaním ľahkých benzínov s dodatočnou premenou produktov
- CnH2n + 2 → 2 C2H2 + CmH2m
Využitie etínu
Používa sa ako technický plyn pri rôznych chemických procesoch a ako palivo do plynových zváračiek a karbidových lámp; zmes acetylénu s kyslíkom horí plameňom s teplotou až 3000 °C.[1] Pri jeho spaľovaní dochádza ku trom rôznym reakciám podľa množstva kyslíka vstupujúceho do reakcie.
- 2 C2H2 + O2 → 4 C + 2 H2O
- 2 C2H2 + 3 O2 → 4 CO + 2 H2O
- 2 C2H2 + 5 O2 → 4 CO2 + 2 H2O
Rozpoznať reakciu je možné podľa teploty plameňa a produkcie sadzí.
V minulosti bol acetylén hlavnou surovinou na výrobu alifatických uhľovodíkov, dnes slúži predovšetkým na výrobu vinyléterov a esterov, 1,4-butándiolu.[1]
Upozornenie
Acetylén je síce netoxický, ale pri vyššej koncentrácii ma po vdýchnutí dusivé a mierne narkotické účinky. Pri tlaku prevyšujúcom 150 kPa (neoverené) alebo privedení do kvapalného alebo tuhého skupenstva samovoľne exploduje. Kvôli tomuto nepríjemnému javu sa vo vysokotlakových nádobách skladuje rozpustený v acetóne.
Referencie
- ↑ a b c d e aetylén. In: Encyclopaedia Beliana. 1. vyd. Bratislava : Encyklopedický ústav SAV; Veda, 1999. 696 s. ISBN 80-224-0554-X. Zväzok 1. (A – Belk), s. 38.
- ↑ Technické plyny . . Dostupné online. (česky)
Externé odkazy
- Údaje o acetyléne (po anglicky)
Text je dostupný za podmienok Creative Commons Attribution/Share-Alike License 3.0 Unported; prípadne za ďalších podmienok. Podrobnejšie informácie nájdete na stránke Podmienky použitia.
Antropológia
Aplikované vedy
Bibliometria
Dejiny vedy
Encyklopédie
Filozofia vedy
Forenzné vedy
Humanitné vedy
Knižničná veda
Kryogenika
Kryptológia
Kulturológia
Literárna veda
Medzidisciplinárne oblasti
Metódy kvantitatívnej analýzy
Metavedy
Metodika
Text je dostupný za podmienok Creative
Commons Attribution/Share-Alike License 3.0 Unported; prípadne za ďalších
podmienok.
Podrobnejšie informácie nájdete na stránke Podmienky
použitia.
www.astronomia.sk | www.biologia.sk | www.botanika.sk | www.dejiny.sk | www.economy.sk | www.elektrotechnika.sk | www.estetika.sk | www.farmakologia.sk | www.filozofia.sk | Fyzika | www.futurologia.sk | www.genetika.sk | www.chemia.sk | www.lingvistika.sk | www.politologia.sk | www.psychologia.sk | www.sexuologia.sk | www.sociologia.sk | www.veda.sk I www.zoologia.sk