A | B | C | D | E | F | G | H | CH | I | J | K | L | M | N | O | P | Q | R | S | T | U | V | W | X | Y | Z | 0 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9
Chalkogenovodíky sú binárne zlúčeniny vodíka s chalkogénmi (prvkami 16. skupiny periodickej tabuľky, teda kyslíkom, sírou, selénom, telúrom a polóniom). Voda, prvá zlúčenina v tomto rade, obsahuje jeden atóm kyslíka a dva atómy vodíka a je to nejbežnejšia zlúčenina na zemskom povrchu.[1]
Chalkogenovodíky s jedným atómom chalkogénu
Najdôležitejším radom chalkogenovodíkov, vrátane vody, sú zlúčeniny, ktorých všeobecný vzorec je H2X, kde X reprezentuje chalkogén. Tieto zlúčeniny sú teda trojatómové. Majú lomenú molekulárnu štruktúru a sú to polárne molekuly. Voda je esenciálna zlúčenina pre existenciu dnešného života na Zemi[2] a pokrýva 70,9 % povrchu planéty. Ostatné chalkogenidy sú zvyšajne extrémne toxické a majú silné nepríjemné zápachy, ktoré pripomínajú hnijúce vajcia alebo zeleninu. Sulfán (H2S) je bežným rozkladným produktom v prostrediach s nízkym obsahom kyslíka a preto je jednou z chemikálí zodpovednou za zápach plynov vznikajúcich v tráviacom trakte človeka. Takisto je súčasťou vulkanických plynov.[3] Napriek jeho toxicite ho ľudské telo produkuje v malých množstvách ako signálnu molekulu.
Vo vode je možné rozpustiť ostatné chalkogény (aspoň po telán), čím vznikajú kyslé roztoky známe ako chalkogenovodíkové kyseliny. Aj keď sú slabšie než halogenovodíkové kyseliny, vykazujú podobný trend zvyšovania sily kyseliny s ťažšími chalkogénmi a takisto vznikajú podobnými spôsobmi (premieňajú vodu na hydrónium H3O+ a HX-). Nie je známe, či polán tvorí kyslé roztoky ako jeho ľahše homológy alespráva skôr ako hydrid kovu (pozri aj astatovodík).
| Zlúčenina (systémový názov)[4] | Ako vodný roztok | Chemický vzorec | Geometria molekuly | pKa | 3D model |
|---|---|---|---|---|---|
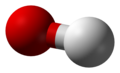
| oxidán | voda | H2O | 13.995 | 
| |
| sulfán | kyselina sírovodíková | H2S | 
|
7.0 | 
|
| selán | kyselina selenovodíková | H2Se | 
|
3.89 | 
|
| telán | kyselina telurovodíková | H2Te | 
|
2.6 | 
|
| polán | kyselina polonovodíková | H2Po | ? | ? | 
|
| livermorán | kyselina livermorovodíková | H2Lv | ? | ? | 
|
Niektoré vlastnosti chalkogenovodíkov sú nasledovné:[5]
| Vlastnosť | H2O | H2S | H2Se | H2Te | H2Po |
|---|---|---|---|---|---|
| Teplota topenia (°C) | 0.0 | −85.6 | −65.7 | −51 | −35.3 |
| Teplota varu (°C) | 100.0 | −60.3 | −41.3 | −4 | 36.1 |
| −285.9 | +20.1 | +73.0 | +99.6 | ? | |
| Väzbový uhol (H–X–H) (plyn) | 104.45° | 92.1° | 91° | 90° | 90.9° (predpokladaný)[6] |
| Disociačná konštanta (HX−, K1) | 1.8 × 10−16 | 1.3 × 10−7 | 1.3 × 10−4 | 2.3 × 10−3 | ? |
| Disociačná konštanta (X2−, K2) | 0 | 7.1 × 10−15 | 1 × 10−11 | 1.6 × 10−11 | ? |
Mnoho zvláštnych vlastností vody v porovnaní s ostatnými chalkogenovodíkmi je možné prisúdiť významnej tvorbe vodíkových väzieb medzi atómami vodíka a kyslíka. Medzi tieto vlastnosti patria vysoké teploty topenia a varu (pri izbovej teplote je to tekutina) ako i vysoká dielektrická konštanta a pozorovateľná iónová disociácia. Vodíkové väzby vo vode takisto zapríčiňujú vysoké hodnoty entalpie a entropie vyparovania, viskozitu a povrchové napätie.[5]
Ostatné chalkogenovodíky sú extremné toxické zapáchajúce plyny. Sulfán sa bežne vyskytuje v prírode a jeho vlastnosti ukazujú v porovnani s vodou neprítomnosť vodíkových väzieb.[5] Keďže vodík i kyslík sú plyny pri štandardných podmienkach, stačí vodík spíliť v prítomnosti kyslíka, čím vzniká voda vo vysoko exotermickej reakcii. Túto skúšku je možné využiť v základoch chémie na overenie plynov vznikajúcich v reakcii, pretože vodík horí s počuteľným puknutím. Voda, sulfán a selán vznikajú spoločným zahriatím ich zložiek nad 350 °C, ale telán a polán touto metódou nevznikajú kvôli ich teplotnej nestablite. Telán sa rozkladá pri vzdušnej vlhkosti, na svetle a pri teplotách nad 0 °C. Polán je nestabilný kvôli silnej rádioaktivite polónia (čím dochádza k rádiolýze po vzniku polánu), takže je možné získať len stopové množstvo pomocou zmiešania zriedeného roztoku kyseliny chlorovodíkovej a horčíkovej fólie pokrytej polóniom. Vlastnosti polánu sú odlišné od ostatných chalkogenovodíkov, keďže polónium je kov, zatiaľ čo ostatné chalkogény nie. Táto zlúčenina je teda akýmsi medzirkokom medzi bežným chalkogenovodíkom alebo halogenovodíkom (napr. chlorovodíkom) a kovovými hydridmi (napr. stanánom). Podone ako voda, prvá zlúčenina v tomto rade, polán je takisto kvapalný pri izbovej teplote. Na rozdiel od vody, u ktorej je vysoká teplota varu spôsobená silnými intermolekulárnymi silami, konkrétne van der Waalsovymi interakciami, je u polánu za vysokú teplotu topenia zodpovedný veľký elektrónový oblak polónia.[5]
Chalkogenovodíky s dvoma atómami chalkogénu
Tieto zlúčeniny majú vzorec H2X2 a sú zvyčajne menej stabilné než chalkogenovodíkmi s jedným atómom chalkogénu. Bežne sa rozkladajú na príslušné zlúčeniny H2X uvedené vyššie.
Najdôležitejšou z týchto zlúčenín je peroxid vodíka, H2O2, ktorý predstavuje slabomodrú až takmer priehľadnú tekutinu, ktorá je menej prchavá než voda a má vyššiu hustotu i viskozitu. Je to dôležitá chemikália, ktorú možno oxidovať i redukovať v roztokoch akéhokoľvek pH, ktorá je schopná tvoriť peroxokovové komplex a peroxokyselinové komplexy a takisto podstupuje mnoho acidobázických reakcií. V menej koncentrovanom roztoku sa používa v domácnostiach, napríklad ako dezinfekcia alebo na bielenie vlasov. Vyššie koncentrácie sú nebezpečnejšie.
| Zlúčenina | Chemický vzorec | Geometria molekuly | 3D model |
|---|---|---|---|
| peroxid vodíka
(dioxidán) |
H2O2 | ||
| disulfán | H2S2 | ||
| diselán | H2Se2 | — | |
| ditelán | H2Te2 | — |
Niektoré vlastnosti chalkogenovodíkov sú nasledovné:
| Property | H2O2 | H2S2 | H2Se2 | H2Te2 |
|---|---|---|---|---|
| Teplota topenia (°C) | -0.43 | −89.6 | ? | ? |
| Teplota varu (°C) | 150.2 (rozkladá sa) | 70.7 | ? | ? |
Alternatívne štruktúrne izoméry týchto chalkogenovodíkov, v ktorých sú oba vodíky viazané na ten istý atóm chalkogénu, ktorý je viazaný na druhý atóm chalkogénu, boli skúmané pomocou výpočtovej chémie. Tieto štruktúry H2X+–X– patria medzi ylidy. Izomér peroxidu vodíka, oxyvoda, nebol pripravený experimentálne. Analogický izomér sulfánu, tiosulfoxid, bol experimentlne zaznamenaný pomocou hmotnostej spektrometrie.[7]
Je možné, aby sa v podobných zlúčeninách vyskytovali dva rôzne chalkoginy, ako je to napríklad v tioperoxide vodíka, H2SO. Známejšie zlúčeniny s podobným popisom (ale viac než dvoma atómami chalkogénov) zahŕňajú napríklad kyselinu sírovú (H2SO4).
Vyššie chalkogenovodíky
Všetky lineárne reťazce chalkogenovodíkov majú vzorec H2Xn.
Vyššie polyoxidy vodíka nie sú stabilné.[5] Trixodián, ktorý má tri kyslíkové atómy, je tranzitný nestabilný intermediát v niekoľkých reakciách. Ďalšie dve zlúčeniny v kyslíkovej rade, tetraoxidán a pentaoxidán, boli takisto syntetizované a sú veľmi reaktívne. Alternatívny štruktúry izomér trixodánu,v ktorom sú vodíkové atómy viazané na stredný atóm kyslíka v lineárnom reťazci namiesto jedného vodíka na každom konci reťazca, bol skúmaný pomocou výpočtovej chémie.[8]
Vyššie polysulfány, H2Sn (n = 3–8), sú známe stabilné zlúčeniny.[9] Majú nevetvené reťazce tvorené atómami sírou, čo ukazuje inklináciu síry ku katenácii (tvorbe reťazcov). Počínajúc disulfánom sú všetky známe polysulfány kvapaliny pri izbovej teplote. Disulfán je bezfarebná zlúčenina, zatiaľ čo ostatné polysulfány majú žltú farbu. Čím dlhší je reťazec, tým je farba intenzívnejšia a takisto sa zvyšuje hustota, viskozita a teplota varu. Tieto vlastnosti sú uvedené v nasledujúcej tabuľke:[10]
| Zlúčenina | Hustota pri 20 °C (g•cm−3) | Tlak výparov (mmHg) | Extrapolovaná teplota varu (°C) |
|---|---|---|---|
| H2S | 1.363 (g•dm−3) | 1740 (kPa, 21 °C) | -60 |
| H2S2 | 1.334 | 87.7 | 70 |
| H2S3 | 1.491 | 1.4 | 170 |
| H2S4 | 1.582 | 0.035 | 240 |
| H2S5 | 1.644 | 0.0012 | 285 |
| H2S6 | 1.688 | ? | ? |
| H2S7 | 1.721 | ? | ? |
| H2S8 | 1.747 | ? | ? |
Tieto zlúčeniny je však možné jednoducho oxidovať a nie sú tepelne stabilné, ľahko sa disproporcionujú nasíru a sulfán. V tejto reakcii pôsobí zásada ako katalyzátov:[10]
- H2Sn → H2S + (n-1)/8 S8
Takisto reagujú so siričitanmi a kyanidmi, čím vznikajú tiosiričitany a tiokyanáty.[10]
Alternatívny štruktúrny izomér trisulfánu, v ktorom sú dva vodíkové atómy viazané na stredný atóm síry v reťazci tvorenom tromi sírami, bol takisto študovaný výpočtovo.[8] Kyselina tiosiričitanová ((HS)2S+–S–), vetvený izomér tetrasulfánu (HS-S-S-SH), v ktorom je štvrtá síra viazaná na centrálny atóm síry v lineárnom trisulfáne, bola takisto študovaná metódami výpočtovej chémie.[11] Kyselina tiosírová, v ktorom sú dva atómy síry viazané na centrálny atóm síry lineárneho trisulfánu, bola takisto študovaná.[12]
Je možné, že existujú i vyššie polány.[13]
Ostatné chalkogenovodíkové zlúčeniny
Existujú niektoré chalkogenovodíky s jedným atómom vodíka a ďalšie boli študované teoreticky. Keďže sú to radikálové zlúčeniny, sú celkom nestabilné. Najjednoduchšímy príkladmi sú hydroxylový (HO•) a hydroperoxylový (HO2•) radikál. Ozonid vodíka (HO3•) je takisto známy[14] spolu s niektorými jeho soľami s alkalickými kovmi (rôzne MO3).[15] Sírne analógy sú HS• a HS2•.
Jeden alebo viac atómov prócia vo vode je možné substituovať za iný jeho izotop, deutérium, čím vzniká poloťažká voda (HDO) a ťažká voda (D2O). Ťažká voda je jednou z najznámejších zlúčenín deutéria. Kvôli veľkému rozdielu hustoty medzi deutériom a próciom má ťažká voda mnoho zvláštnych vlastností. Podobne je možné použiť rádioizotop trícium. Ďalšou významnou zlúčeninou je deuterovaný disulfán (DSSD). Deuterovaný telán (D2Te) je o niečo viac tepelne stabilný než obyčajný telán (H2Te) a bol experimentálne použitý na chemickú deponáciu tenkých vrstiev založených na teluride.[16]
Vodík má mnoho vlastností spoločných s halogénmi, jeho náhradou za halogén vznikajú halogenidy chalkogénov, napríklad difluorid kyslíka (OF2) a oxid chlórny (Cl2O), popri zlúčeninách, ktoré sú s vodíkom nemožné (napr. oxid chloričitý).
Ióny s vodíkom
Jeden z najznámejších iónov chalkogenovodíka je hydroxidový anión, ktorý je príbuzný hydroxylovej funkčnej skupine. Tento anión vystupuje v hydroxidoch alkalických kovov, kovov alkalických zemín a kovov vzácnych zemín, ktoré vznikajú reakciou daného kovu s vodou. Hydroxylová skupina sa bežne objavuje v organickej chémii, napríklad s alkoholmi. Príbuzné hydrogénsulfidy/sulfhydrylové skupiny sa vyskytujú v hydrogénsulfidoch a tioloch.
Hydrónium (H3O+) je prítomné v kyslých vodných roztokoch, ktoré zahŕňajú i roztoky chalkogenovodíkových kyselín, ako i v čistej vode, kde je prítomné spolu s hydroxidom.
Referencie
- ↑ CIA – The world factbook . Central Intelligence Agency. Dostupné online.
- ↑ About the International Decade for Action 'Water for Life' 2005-2015 . . Dostupné online.
- ↑ Volcanic gases can be harmful to health, vegetation and infrastructure | U.S. Geological Survey . www.usgs.gov, . Dostupné online.
- ↑ KRIVOSUDSKÝ, Lukáš; GALAMBOŠ, Michal; LEVICKÁ, Jana. STRUČNÝ SPRIEVODCA NÁZVOSLOVÍM ANORGANICKEJ CHÉMIE . Vydavateľstvo UK, 2021, . Dostupné online.
- ↑ a b c d e GREENWOOD, Norman; EARNSHAW, Alan. Chemistry of the Elements. 2. vyd. : Butterworth-Heinemann, 1997. ISBN 978-0-08-037941-8. S. 623, 633–638, 682, 766-767.
- ↑ Electronic states and potential energy surfaces of H2Te, H2Po, and their positive ions. Journal of Chemical Physics, 1990, s. 6604–6619. DOI: 10.1063/1.458298.
- ↑ Thiosulfoxides (X2S=S) and disulfanes (XSSX): first observation of organic thiosulfoxides. International Journal of Mass Spectrometry, 2000, s. 239–249. DOI: 10.1016/S1387-3806(99)00227-4.
- ↑ a b Chemical Bonding in Hypervalent Molecules Revised. 2. Application of the Atoms in Molecules Theory to Y2XZ and Y2XZ2 (Y = H, F, CH3; X = O, S, Se; Z = O, S) Compounds. J. Am. Chem. Soc., 1999, s. 3156–3164. DOI: 10.1021/ja9828206.
- ↑ STEUDEL, Ralf. Inorganic Polysulfanes H2Snwith n > 1. Berlin, Heidelberg : Springer, 2003. DOI: 10.1007/b13182. Dostupné online. ISBN 978-3-540-44951-5. DOI:10.1007/b13182 S. 99–126. (po anglicky)
- ↑ a b c Greenwood and Earnshaw, p. 683
- ↑ Ab initio study of hypervalent sulfur hydrides as model intermediates in the interconversion reactions of compounds containing sulfur–sulfur bonds. J. Am. Chem. Soc., 1987, s. 710–714. DOI: 10.1021/ja00237a012.
- ↑ Hypervalency in sulfur? Ab initio and DFT studies of the structures of thiosulfate and related sulfur oxyanions. Sulfur Letters, 2003, s. 171–180. DOI: 10.1080/02786110310001622767.
- ↑ LIU, Yunxian; DUAN, Defang; TIAN, Fubo. Phase diagram and superconductivity of polonium hydrides under high pressure. arXiv:1503.08587 , 2015-03-30. ArXiv: 1503.08587. Dostupné online .
- ↑ Experimental Detection of Hydrogen Trioxide. Science, 1999, s. 81–82. DOI: 10.1126/science.285.5424.81. PMID 10390365.
- ↑ Wiberg 2001, p. 497
- ↑ Xiao, M. & Gaffney, T. R. Tellurium (Te) Precursors for Making Phase Change Memory Materials. (Google Patents, 2013) (https://www.google.ch/patents/US20130129603)
Zdroj
Tento článok je čiastočný alebo úplný preklad článku Hydrogen chalcogenide na anglickej Wikipédii.
Text je dostupný za podmienok Creative Commons Attribution/Share-Alike License 3.0 Unported; prípadne za ďalších podmienok. Podrobnejšie informácie nájdete na stránke Podmienky použitia.
Text je dostupný za podmienok Creative
Commons Attribution/Share-Alike License 3.0 Unported; prípadne za ďalších
podmienok.
Podrobnejšie informácie nájdete na stránke Podmienky
použitia.
www.astronomia.sk | www.biologia.sk | www.botanika.sk | www.dejiny.sk | www.economy.sk | www.elektrotechnika.sk | www.estetika.sk | www.farmakologia.sk | www.filozofia.sk | Fyzika | www.futurologia.sk | www.genetika.sk | www.chemia.sk | www.lingvistika.sk | www.politologia.sk | www.psychologia.sk | www.sexuologia.sk | www.sociologia.sk | www.veda.sk I www.zoologia.sk