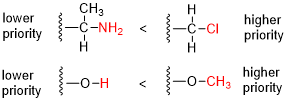A | B | C | D | E | F | G | H | CH | I | J | K | L | M | N | O | P | Q | R | S | T | U | V | W | X | Y | Z | 0 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9
Cahnov-Ingoldov-Prelogov R,S-systém (iné názvy: Cahnova–Ingoldova–Prelogova nomenklatúra,[chýba zdroj Cahnovo-Ingoldovo-Prelogovo názvoslovie,[1] pravidlá poradia CIP,[chýba zdroj Cahnove-Ingoldove-Prelogove pravidlá,[2][3][4] CIP pravidlá[3]) pomenovaný podľa organických chemikov Roberta Sidneyho Cahna, Christophera Kelka Ingolda a Vladimira Preloga je štandardný proces kompletného a jednoznačeného pomenovávania stereoizomérov molekúl v organickej chémii.[5][6][7] Princípom pravidiel CIP je určiť deskriptor R alebo S na každom stereocentre a deskriptor E alebo Z na každej dvojitej väzbe tak, aby v systematickom názve bola špecificky určená konfigurácia celej molekuly i pomocou týchto deskriptorov. Molekula môže obsahovať ľubovoľný počet stereocentier a dvojitých väzieb a každé z nich môže existovať v dvoch izoméroch. Molekula s n stereogénnymi centrami má zvyčajne 2n stereoizomérov a 2n−1 diastereomérov (párov enantiomérov).[8][9] Pravidlá poradia CIP napomáhajú presnému pomenovaniu všetkých stereomérov všetkých organických a organokovových molekúl, v ktorých majú všetky atómy 4 alebo menej väzieb (prípadne 6, kedy sa jedná o "počet susediacich atómov" na danom centre).[5][8]
Kľúčový článok predstavujúci pravidlá CIP bol publikovaný v roku 1966[10] a potom ho nasledovali ďalšie úpravy,[11] než bol v roku 1974 doplnený do pravidiel Medzinárodnej únie pre čistú a aplikovanú chémiu (IUPAC), ktorá určuje organické názvoslovie.[5] Odvtedy boli pravidlá upravované, naposledy v roku 2013,[12] a sú súčasťou knihy Názvoslovie organických zlúčenín od IUPAC.
Jeden z novších článkov navrhuje isté zmeny k niektorým pravidlám (konkrétne 1b a 2), u ktorých nie sú jasné správne deskriptory.[13] Ostáva však iný problém: vo vzácnych prípadoch majú dva rôzne stereoizoméry tej istej molekuly zhodné CIP deskriptory, takže CIP pravidlá nemusia byť schopné pomenovať stereomér jednoznačne a môže byť lepšie využiť iné názvoslovie.[14]
Postup v pomenovávaní
Jednotlivé kroky v pomenovávaní pomocou pravidiel CIP sú:
- Identifikácia stereocentier a dvojitých väzieb
- Určenie priorít skupín napojených na každé stereocentrum alebo atóm dvojitej väzby
- Priradenie R/S a E/Z deskriptorov
Určenie priorít
R/S a E/Z deskriptory sú priradené podľa pravidiel určovania priorít skupín naviazaných na každé stereocentrum. Tento proces je hlavnou časťou CIP pravidiel. Prehľad pravidiel uvedený v tejto sekcii vynecháva niektoré pravidlá vyžadované len vo vzácnych prípadoch:
- Porovnáme protónové čísla (Z) atómov naviazaných priamo na stereocentrum; skupina s atómom s vyšším protónovým číslom má vyššiu prioritu.[7]
- V prípade zhody porovnáme atómy vo vzdialenosti 2 od stereocentra — vytvoríme zoznam atómov pre každú skupinu atómov naviazaných priamo na atóm naviazaný na stereocentrum. Každý zoznam musí byť usporiadaný zostupne podľa atómového čísla. Následne porovnávame zoznamy po atómoch: pri prvom rozdiele priradíme vyššiu prioritu skupine s vyšším protónovým číslom.
- Ak i v tomto prípade nastane zhoda, každý atóm v týchto zoznamoch sa nahradí ďalším zoznamom atómov, ktoré sú naňho naviazané (vo vzdialenosti 3 od stereocentra); tieto nové zoznamy sú znovu usporiadané zostupne podľa protónového čísla a celá štruktúra sa znovu porovnáva po jednotlivých atómoch. Proces sa rekurzívne opakuje až kým sa nerozhodne, ktorá skupina má vyššiu prioritu, zakaždým o jednu väzbu ďalej od stereocentra.
Izotopy
Ak sa dve skupiny líšia len v izotopoch, tak má prioritu vyššia atómová hmotnosť.
Dvojité a trojité väzby
Ak je atóm A viazaný dvojitou väzbou na atóm B, atóm A je vnímaný ako viazaný obyčajnou väzbou na dva atómy: atóm B a "fantómový atóm", ktorý je duplikátom B (má zhodné atómové číslo), ale nie je naviazaný na nič iné okrem atómu A. Keď je B nahradené zoznamom naviazaných atómov, vynechá sa atóm A, ale nie jeho "fantómový atóm"; atóm A sa vynechá, aby sa zabránilo návratu po väzbe, po ktorej sa postupovalo k atómu B. Postup pri trojitej väzbe je potom rovnaký, len majú atómy A i B dva fantómové atómy toho druhého.[5]
Geometrické izoméry
Ak sú dva substituenty na vzájomné atóme geometrické izoméry, má Z-izomér prednosť oproti E-izoméru.
Cyklické molekuly
Pre molekuly, ktoré majú jeden alebo viac cyklov, je nutné najprv molekuly zapísať ako strom pomocou prechodu cez všetky možné cesty začínajúce u stereocentra. Ak sa znovu narazí na atóm, ktorý už sa v strome nachádza, vytvorí sa fantómový atóm podobne ako pri násobných väzbách, aby bol strom konečný. Jeden atóm v pôvodnej molekule sa teda môže v strome objaviť na viacerých miestach (niektoré ako fantómové atómy, niektoré ako pôvodné).[15]
Priradenie deskriptorov
Stereocentrá: R/S
Po tom, čo boli určené priority substituentov na stereocentre, molekula sa orientuje v priestore tak, aby skupina s najnižšou prioritou smerovala od pozorovateľa. Ak sú substituenty očíslované od 1 (najvyššia priorita) po 4 (najnižšia priorita), potom smer rotácie krivky prechádzajúcej cez vetvy označené 1, 2 a 3 odlíšiť stereoméry.[7] Stereocentrum s rotáciou v smere hodinových ručičiek sa označuje ako R (rectus) a stereocentrum s rotáciou proti smeru hodinových ručičiek sa označuje S (sinister). Tieto názvy pochádzajú z latinských výrazov pre "vpravo" a "vľavo".[16][17]
Praktickou metódou určovania deskriptorov daného enantioméru je použitie pravidla pravej ruky: molekula sa objíme prstami pravej ruky v smere 1 → 2 → 3. Ak palec ukazuje smerom k štvrtému substituentu, enantiomér je R, inak je to S.
Vo výnimočných prípadoch sa môže stať, že sa substituenty líšia len v ich absolútnej konfigurácii (R alebo S). Ak je nutné určiť relatívne priority týchto substituentov, R má prioritu nad S. Ak nastane táto situácia, deskriptor stereocentra sa píše malým písmenom (r alebo s) namiesto veľkých písmen, ktoré sa bežne používajú.[18]
Dvojité väzby: E/Z
Pre alkény a iné molekuly s dvojitou väzbou sa používa rovnaký proces určovania priorít ich substituentov. V tomto prípade záleží na usporiadaní dvoch substituentov s najvyššou prioritou voči dvojitej väzbe. Ak sú oba substituenty na rovnakej strane väzby, teda v cis konfigurácii, tak je stereoméru priradený deskriptor Z (zusammen). Naopak ak sú v trans konfigurácii, tak je stereoméru priradený deskriptor E (entgegen). Tieto názvy sú odvodené z nemeckých výrazov pre "spolu" a "oproti".
Príklady
V nasledujúcej tabuľke sú uvedené príklady použitia tohto názvoslovia.[19]
Určenie R/S pre niekoľko zlúčenín Hypotetická molekula brómochlórofluórjódometán v jej (R)-konfigurácii by bola jednoduchá chirálna zlúčenina. Priority sú určené podľa protónového čísla (Z): jód (Z = 53) > bróm (Z = 35) > chlór (Z = 17) > fluór (Z = 9). Keď fluór (najnižšia priorita) ukazuje smerom od pozorovateľa, zvyšné atómy budú zoradené v smere hodinových ručičiek a teda bude mať táto molekula deskriptor R. Pri určovaní L-serínu má najvyššiu prioritu dusík (Z = 7) v amínoskupine. Hydroxymetyl (CH2OH) i karboxylová skupina (COOH) majú uhlíkový atóm (Z = 6), ale vyššiu prioritu má COOH skupina spojená na druhý kyslík (Z = 8), zatiaľ čo v CH2OH skupine je uhlík viazaný na vodík (Z = 1). Najnižšiu prioritu má vodíkový atóm a keď tento atóm ukazuje smerom od pozorovateľa, tak sú substituenty zoradené proti smeru hodinových ručičiek, takže majú konfiguráciu S. Stereocentrum v (S)-karvóne je viazané na jeden vodík (nie je ukázaný, priorita 4) a tri uhlíkové atómy. Izopropenylová skupina má prioritu 1 (má len uhlíkové atómy) a priorita zvyšných dvoch uhlíkových atómov je určená podľa uhlíkov na nich naviazaných: jeden je súčasťou ketoskupiny (O, O, C, priorita 2) a druhý súčasťou alkénu (C, C, H, priorita 3). Výsledná rotácia proti smeru hodinových ručičiek dáva deskriptor S.
Popis viacerých stereocentier
Ak má zlúčenina viac než jedno stereocentrum, každé centrum má deskriptor buď R, alebo S. Napríklad efedrín existuje v stereoizoméroch (1R,2S) a (1S,2R), ktoré sú vzájomnými zrkadlovými obrazmi - sú to teda enantioméry. Táto molekula potom existuje ešte v enantioméroch (1R,2R) a (1S,2S), ktoré sú nazývané pseudoefedrín namiesto efedrínu. Všetky štyri izoméry sa nazývajú 2-metylamíno-1-fenyl-1-propanol v systematickom názvosloví. Efedrín a pseudoefedrín sú diastereoméry, respektíve stereizoméry, ktoré nie sú enantioméry, pretože nie sú vzájomnými zrkadlovými obrazmi. Pseudoefedrín a efedrín majú rôzne názvy, pretože keďže sú to diasetereoméry, majú rôzne chemické vlastnosti, a to i v podobe racemátu.
Všeobecne platí, že pre akýkoľvek pár enantiomérov sú všetky deskriptory opačné: (R,R) a (S,S) sú enantioméry, rovnako ako (R,S) a (S,R). Diastereoméry majú aspoň jeden deskriptor spoločný: napríklad (R,S) a (R,R) sú diastereoméry, rovnako ako (S,R) a (S,S). Obdobne to platí i pre molekuly s väčším počtom stereocentier: ak majú stereoizoméry aspoň jeden deskriptor zhodný, sú to diastereoméry. Ak majú všetky deskriptory opačné, sú to enantioméry.
Ak numerické označenie stereocentier nie je unikátne kvôli symetrii celej molekuly, jedná sa o mezo zlúčeninu, ako je napríklad kyselina mezo-vínna, u ktorej je (R,S) forma rovnaká ako (S,R) forma. V mezo zlúčeninách sa R a S stereocentrá nachádzajú v symetricky umiestnených pároch.
Relatívna konfigurácia
Relatívna konfigurácia dvoch stereoizomérov môže byť značená pomocou deskriptorov R a S s hviezdičkou (*). (R*,R*) znamená, že dve centrá majú rovnakú konfiguráciu, teda (R,R) alebo (S,S); (R*,S*) naznačuje dve centrá s opačnou konfiguráciou, teda (R,S) alebo (S,R). Pri tomto použití je stereogénne centrum s najnižším číslom (podľa číslovania podľa IUPAC) označené deskriptorom R*.
Pri určení dvoch anomérov sa využívajú relatívne stereodeskriptory alfa (α) a beta (β). Pri α anomére májú anomérny uhlík a referenčný atóm opačné konfigurácie (R,S) alebo (S,R), zatiaľ čo pri β anomére sú zhodné, (R,R) alebo (S,S).[20]
Strany
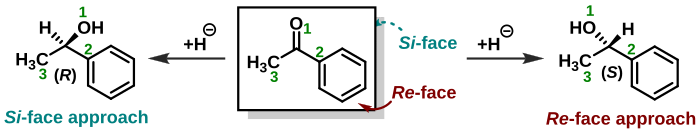
Stereochémia sa objavuje i pri určovaní strán u trigonálnych molekúl ako sú ketóny. Nukleofil môže v nukleofilnej adícii pristúpiť ku karbonylovej skupine z dvoch opačných strán. Ak achirálny nukleofil atakuje acetón, obe strany sú identické a vzniká len jeden produkt. Ak nukleofil atakuje butanón, strany sú rôzne (enantiotopické) a vzniká racemát. Ak je nukleofil chirálny, vznikajú diastereoméry. Ak je jedna strana molekuly zakrytá substituentmi alebo geometrickými obmedzeniami v porovnaní s druhou stranou, nazývajú sa strany diastereotopické. Na určenie strany sa využívajú rovnaké pravidlá ako pri určovaní stereocentrier. Strany sa potom nazývajú Re-strana a Si-strana.[21][22] V príklade napravo je acetofenón zobrazený z Re-strany. Pri adícii hydridu (redukcia) na túto stranu vzniká (S)-enantiomér a pri adícii na Si-stranu vzniká (R)-enantiomér. Je však nutné si uvedomiť, že adícia na prochirálne centrum z Re-strany nemusí vždy viesť k (S)-stereocentru, keďže sa musí uvážiť priorita adovanej skupiny. To znamená, že stereochémia produktu musí byť určená samostatne a nedá sa všeobecne určiť podľa toho, na ktorú stranu bola skupina adovaná. V uvedenom príklade by pri ataku chloridu (Z = 17) na prochirálne centrum z Re-strany vznikol (R)-enantiomér.
Referencie
- ↑ PřF:C2021 Organická chemie I - Informace o předmětu . is.muni.cz, . Dostupné online.
- ↑ PřF:C2700 Organická chemie - Informace o předmětu . is.muni.cz, . Dostupné online.
- ↑ a b LITERÁK, Jaromír. Prostorové uspořádání molekul organických sloučenin . . Dostupné online.
- ↑ BŘÍŽĎALA, Jan. Organická chemie pro gymnázia. : , 2020. (1. vydání.) Dostupné online. ISBN 978-80-270-8161-5.
- ↑ a b c d CROSS, L.C; KLYNE, W.. Rules for the Nomenclature of Organic Chemistry: Section E: Stereochemistry (Recommendations 1974). : , 1974. Dostupné online. ISBN 978-0-08-021019-3.
- ↑ MARCH, Jerry; MICHAEL B., Smith. March's advanced organic chemistry : reactions, mechanisms, and structure. 6.. vyd. Hoboken, NJ : Wiley-Interscience, 2007. ISBN 978-0-471-72091-1. S. 155–162.
- ↑ a b c Cahnov-Ingoldov-Prelogov R,S-systém. In: BÍNA, Jaroslav. Malá encyklopédia chémie. Bratislava : Obzor, 1981. S. 155.
- ↑ a b "Zvyčajne" nemusí vždy platiť - napríklad v prípade mezo-zlúčenín, ktoré majú chirálne centrá i rovinu symetrie, môžu byť niektoré stereoizoméry "degenerované" (identické) práve kvôli symetrii roviny, takže tento matematický výraz nadhodnocuje celkový počet stereomérov. Viď Clayden, op. cit., str. 317.
- ↑ Clayden, Jonathan; Greeves, Nick; Warren, Stuart. Organic Chemistry. 2nd. vyd. Oxford, UK : Oxford University Press, 2012. Dostupné online. ISBN 978-0199270293. S. 316f.
- ↑ Cahn, R.S.; Ingold, C.K.; Prelog, V.. Specification of Molecular Chirality. Angewandte Chemie International Edition, 1966, s. 385–415. DOI: 10.1002/anie.196603851.
- ↑ Prelog, V.; Helmchen, G.. Basic Principles of the CIP-System and Proposals for a Revision. Angewandte Chemie International Edition, 1982, s. 567–58. DOI: 10.1002/anie.198205671.
- ↑ IUPAC Chemical Nomenclature and Structure Representation Division (2013). "P-9". In Favre, Henri A.; Powell, Warren H. (eds.). Nomenclature of Organic Chemistry: IUPAC Recommendations and Preferred Names 2013. IUPAC–RSC. ISBN 978-0-85404-182-4.
- ↑ Algorithmic Analysis of Cahn-Ingold-Prelog Rules of Stereochemistry: Proposals for Revised Rules and a Guide for Machine Implementation. Journal of Chemical Information and Modeling, 30 July 2018, s. 1755–1765. Dostupné online. DOI: 10.1021/acs.jcim.8b00324. PMID 30059222.
- ↑ Mayfield, John; Lowe, Daniel; Sayle, Roger (2017). Comparing CIP implementations: The need for an open CIP. Abstracts of papers of the American Chemical Society. 254. Retrieved 2020-07-22. Abstract on publisher web site

- ↑ Basic Principles of the CIP-System and Proposals for a Revision. Angewandte Chemie International Edition in English, August 1982, s. 567–583. DOI: 10.1002/anie.198205671.
- ↑ KLEIN, David R.. Organic Chemistry. 2nd. vyd. s.l. : Wiley, 2013-12-31. ISBN 978-1118454312. S. 203. (po anglicky)
- ↑ An introduction to the sequence rule: A system for the specification of absolute configuration. Journal of Chemical Education, March 1964, s. 116. DOI: 10.1021/ed041p116.
- ↑ IUPAC, Compendium of Chemical Terminology, 2nd ed. (the "Gold Book") (1997). Online corrected version: (2006–) "pseudo-asymmetric carbon atom". DOI:10.1351/goldbook.P04921
- ↑ Harold Hart; Christopher M. Hadad; Leslie E. Craine. Organic Chemistry: A Short Course. s.l. : Cengage Learning, 1 January 2011. Dostupné online. ISBN 978-1-133-17283-3. S. 177–.
- ↑ IUPAC, Compendium of Chemical Terminology, 2nd ed. (the "Gold Book") (1997). Online corrected version: (2006–) "Relative Configuration". DOI:10.1351/goldbook.R05260
- ↑ Moss, G. P.. Basic terminology of stereochemistry (IUPAC Recommendations 1996). Pure and Applied Chemistry, 1996, s. 2193-2222. DOI: 10.1351/pac199668122193.
- ↑ IUPAC, Compendium of Chemical Terminology, 2nd ed. (the "Gold Book") (1997). Online corrected version: (2006–) "Re, Si". DOI:10.1351/goldbook.R05308
Pozri ajupraviť | upraviť zdroj
Zdrojupraviť | upraviť zdroj
Tento článok je čiastočný alebo úplný preklad článku Cahn–Ingold–Prelog priority rules na neurčenej Wikipédii.
Text je dostupný za podmienok Creative Commons Attribution/Share-Alike License 3.0 Unported; prípadne za ďalších podmienok. Podrobnejšie informácie nájdete na stránke Podmienky použitia.
Anomér
Asymetrický uhlík
Atropoizoméria
Cahnov-Ingoldov-Prelogov R,S-systém
Cahnova-Ingoldova-Prelogova nomenklatúra
Chiralita (chémia)
Cis-trans izoméria
Deskriptor (chémia)
Diastereomér
Enantiomér
Text je dostupný za podmienok Creative
Commons Attribution/Share-Alike License 3.0 Unported; prípadne za ďalších
podmienok.
Podrobnejšie informácie nájdete na stránke Podmienky
použitia.
www.astronomia.sk | www.biologia.sk | www.botanika.sk | www.dejiny.sk | www.economy.sk | www.elektrotechnika.sk | www.estetika.sk | www.farmakologia.sk | www.filozofia.sk | Fyzika | www.futurologia.sk | www.genetika.sk | www.chemia.sk | www.lingvistika.sk | www.politologia.sk | www.psychologia.sk | www.sexuologia.sk | www.sociologia.sk | www.veda.sk I www.zoologia.sk