
A | B | C | D | E | F | G | H | CH | I | J | K | L | M | N | O | P | Q | R | S | T | U | V | W | X | Y | Z | 0 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9
Infračervená spektroskopia (IR spektroskopia alebo vibračná spektroskopia) je chemická metóda, pomocou ktorej sa meria interakcia infračerveného žiarenia s látkami. Pri interakcii môže dôjsť k absorpcii, emisii alebo odrazu žiarenia. Používa sa na skúmanie a identifikáciu chemických látok alebo funkčných skupín v pevnom, kvapalnom i plynnom skupenstve. Dá sa použiť na charakterizáciu nových materiálov alebo identifikáciu či overenie známych vzoriek. Infračervená spektroskopia sa robí pomocou zariadenia nazývaného infračervený spektrometer (alebo spektrofotometer), ktorý produkuje infračervené (IR) spektrum. Infračervené spektrum možno potom zobraziť ako graf absorbancie (či transmitancie) infračerveného žiarenia na vertikálnej osi v závislosti na frekvencii, vlnočte alebo vlnovej dĺžke na horizontálnej osi. Na horizontálnej osi sa bežne používa vlnočet v jednotkách reciprokých centimetrov, teda cm-1. Vlnová dĺžka je u infračervenej spektroskopie približne rovná mikrometrom (označovaným i ako mikróny), značka μm, ktoré sú prevrátenou hodnotou reciprokých centimetrov. Bežných laboratórnym prístrojom, ktorý využíva túto spektroskopiu, je infračervený spektrometer s Fourierovou transformáciou (FTIR). Takisto je možné merať i dvojdimenzionálne IR spektrá.
Infračervená časť elektromagnetického spektra sa zvyčajne delí na tri časti – blizke (angl. near), stredné (angl. mid) a vzdialené (angl. far), podľa ich vzájomnej polohy voči viditeľnému spektru. Z týchto troch oblastí, najvyššiu energiu má blízke infračervené spektrum (angl. near-infrared alebo NIR), ktoré sa nachádza približne pri 14 000–4 000 cm−1 (vlnová dĺžka 0,7–2,5 μm) a je schopné excitovať overtoneové vibrácie a kombinácie módov molekulárnych vibrácií. Stredné infračervené spektrum (angl. mid-infrared alebo MIR), ktoré sa nachádza približne pri 4 000–400 cm−1 (2,5–25 μm) sa všeobecne používa na štúdium základných vibrácií a s nimi súvisiacich rotačne-vibračných štruktúr. Vzdialené infračervené spektrum (angl. far-infrared alebo FIR), ktoré sa nachádza približne pri 400–10 cm−1 (25–1 000 μm) ma nízku energiu a možno ho použiť na rotačnú spektroskopiu a nízkofrekvenčné vibrácie. Oblasť 2–130 cm−1, ktoré je na hranici s mikrovlnným žiarením, možno použiť na štúdium medzimolekulových vibrácií.[1] Názvy týchto oblastí sú dohodou a sú len zbežne založené na relatívnych molekulárnych a elektromagnetických vlastnostiach.
Teória
Infračervená spektroskopia využíva to, že molekuly absorbujú elektromagnetické žiarenie s konkrétnymi frekvenciami, ktoré je charakteristické pre ich štruktúru. Tieto absorpcie nastávajú pri takzvaných rezoznančných frekvenciách, teda v prípadoch, kedy frekvencia absorbovaného žiarenia odpovedá vibračnej frekvencii. Energia je ovplyvnená tvarom molekulárnej hyperplochy potenciálnej energie, hmotnosťami atómov a súvisiacimi vibronickými prechodmi (zmenami elektrónovej štruktúry v závislosti na zmene polohy atómov).[2]

V rámci Bornovej-Oppenheimerovej a harmonickej aproximácie (teda keď molekulový Hamiltonián odpovedajúci základnému elektrónovému stavu možno aproximovať pomocou harmonického oscilátoru v okolí rovnovážnej molekulárnej geometrie) súvisia rezonančné frekvencie s normálnymi vibračnými módmi odpovedajúceho molekulárneho elektrónového základného stavu na hyperploche potenciálnej energie.[chýba zdroj
Rezonančné frekvencie takisto súvisia so silou väzby a hmotnosťou atómov na koncoch väzby. Frekvencia vibrácií je teda spojená s konkrétnym normálnym módom pohybu a s konkrétnym druhom väzby.[chýba zdroj
Počet vibračných módov
Aby bol vibračný mód aktívny (pozorovateľný) v infračervenej spektroskopii, musí počas neho vznikať tranzitný dipólový moment. Nie je nutné, aby molekula mala permanentný dipólový moment, keďže pravidlo vyžaduje iba zmenu dipólového momentu.[2][3]
Molekula môže vibrovať mnohými spôsobmi, pričom každý z nich sa označuje ako vibračný mód. Pre molekulu, ktorá má N atómov, molekuly s lineárnou geometriou majú 3N-5 vibračných módov a nelineárne molekuly majú 3N-6 vibračných módov.[2] Oxid uhličitý je lineárna molekula s tromi atómami, takže má 3×3-5 = 4 vibračné módy, naproti tomu voda je nelineárna molekula s 3 atómami, takže má 3×3-6 = 3 vibračné módy. Tento počet je daný počtom stupňov voľnosti pohybov jednotlivých atómov. Každý atóm má tri stupne voľnosti, teda sa môže pohybovať v ktoromkoľvek smere v kartézskej sústave súradníc. Preto má molekula celkom 3N stupňov voľnosti. Tri pohyby však odpovedajú súčasnému pohybu všetkých atómov v jednom smere, takže odpovedajú translácii (pohybu v priestore). Ďalšie tri potom zachovávajú dĺžky väzieb a väzbové uhly a v skutočnosti odpovedajú rotáciám celej molekuly v priestore. Preto majú nelineárne molekuly 3N - 3 translácie - 3 rotácie = 3N-6 vibračných módov. Pre lineárne molekuly jedna rotácia (okolo osi v ktorej molekula leží) nemení usporiadanie molekuly, takže potom existuje 3N - 3 translácie - 2 rotácie = 3N-5 vibračných módov.[2] Akúkoľvek zložitejšiu vibráciu molekuly potom možno popísať ako nejakú kombináciu jednotlivých vibračných módov.
Jednoduché dvojatómové molekuly majú len jednu väzbu a len jeden vibračný mód. Ak je táto molekula symetrická, napríklad N2, tak túto vibráciu nemožno pozorovať v infračervenej spektroskopii (nedochádza k vzniku prechodného dipólového momentu), ale je možné ju pozorovať v Ramanovom spektre (pretože dochádza k zmene polarizácie molekuly). Asymetrické dvojatómové molekuly, napríklad CO, absorbujú i v infračervenom spektre.[2] Zložitejšie molekuly majú viac väzieb a ich vibračné spektra sú teda zložitejšie, takže veľké molekuly absorbujú v infračervenom spektre na mnohých miestach.
Atómy v skupine CH2X2, ktorá sa bežne vyskytuje v organických zlúčeninách a kde X môže byť akýkoľvek iný atóm, môžu vibrovať celkom deviatimi rôznymi spôsobmi. Šesť týchto vibrácií súvisí len s CH2 skupinou:
- dve valenčné (mení sa len dĺžka väzieb, ale nie uhol; v):[chýba zdroj
- symetrická (vs)
- antisymetrická (vas)
- štyri deformačné (mení sa väzbový uhol):[chýba zdroj
- nožnicová (δ)
- kývavá (ρ)
- vejárová (ω)
- krútivá (τ)
Tieto vibrácie sú zobrazené v tabuľke nižšie. Molekuly, v ktorých chýbajú dodatočné atómy X, majú menej vibrácii, pretože niektoré módy sú určené vzťahmi k týmto skupinám. Napríklad v prípade molekuly vody neexistuje kývavý, vejárový a krútivý mód, pretože tieto módy reprezentujú jednoduchú rotáciu celej molekuly a nie vibrácie v rámci molekuly. V prípade zložitejších molekúl môžu byť prítomné i ďalšie vibračné módy.[2]
| Symetrická | Antisymetrická | |
|---|---|---|
| Valenčná | 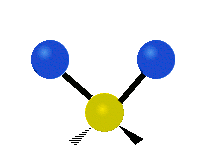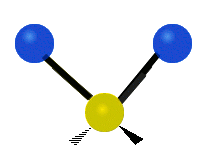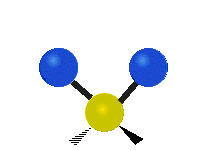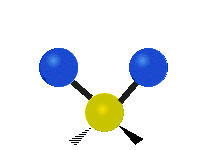 (νs) |
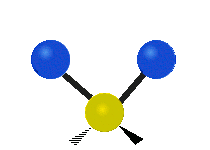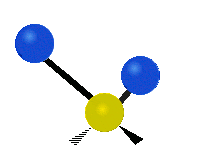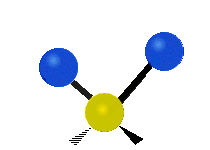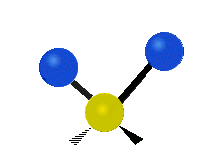 (νas) |
| Deformačná |  nožnicová (δ) |
 kývavá (ρ) |
 vejárová (ω) |
 krútivá (τ) |
Na týchto obrázkoch nie je zobrazený pohyb uhlíkového atómu (žltého atómu v strede), ktorý je síce nutný na vyrovnanie celkového pohybu molekuly, ale jeho pohyb je výrazne menší než pohyb ľahších vodíkových atómov.
Najjednoduchšie a najdôležitejšie, zvané fundamentálne, vibračné pásy vznikajú excitáciou normálnych módov, teda najjednoduchších skrivení molekuly, zo základného stavu s vibračným kvantovým číslom v = 0 do prvého excitovaného stavu s vibračným kvantovým číslom v = 1. V niektorých prípadoch možno pozorovať overtoney. Tie sa objavujú v prípadoch prechodov zo základného stavu do druhého excitovaného vibračného stavu (v = 2). Takýto pás sa objavuje pri približne dvojnásobnej energie oproti fundamentálnemu pásu toho istého normálneho módu. Niektoré excitácie, takzvané kombinované módy, spočívajú v súčasnej excitácii viac než jedného normálneho módu. Tento fenomén Fermiho rezonancie môže vznikať, ak majú dva módy podobnú energiu. Fermiho rezonancia potom vzniká na základe neočakávaného posunu energie a intenzity pásov.[2]
Absorpčné pásy
IR spektroskopia sa často používa kvôli tomu, že je vďaka nej možné identifikovať funkčné skupiny prítomné v molekule, pretože tieto skupiny vykazujú charakteristické pásy v infračervenom spektre. Tieto pásy sú charakaterizované ich polohou (frekvenciou/vlnočtom) a intenzitou.
Oblasti
Spektrograf je často rozdelený na dve časti:[4]
- oblasť funkčných skupín
- V tejto oblasti je často jeden alebo niekoľko pásov pre každú funkčnú skupinu.[4]
- oblasť odtlačku prsta
- V tejto oblasti je mnoho pásov, ktoré tvoria zložitý vzor, ktorý je možné použiť ako "odtlačok prsta" konkrétnej molekuly.[4]
Badgerovo pravidlo
U mnohých druhov vzoriek sú známe priradenia jednotlivých pásov, teda je známe, ktoré zmeny dĺžiek či uhlov väzieb prislúchajú danej frekvencii. V týchto prípadoch je možné určiť i silu väzby pomocou empirického pravidla nazývaného Badgerovo pravidlo. Pôvodne ho publikoval Richard McLean Badger v roku 1934 a toto pravidlo hovorí, že sila väzby (resp. silová konštanta väzby) dvojatómových molekúl koreluje s dĺžkou väzby.[5] To znamená, že zvýšenie sily väzby vedie k skráteniu väzby a naopak.
Referencie
- ↑ Terahertz pulsed spectroscopy and imaging in the pharmaceutical setting--a review. The Journal of Pharmacy and Pharmacology, February 2007, s. 209–23. DOI: 10.1211/jpp.59.2.0008. PMID 17270075.
- ↑ a b c d e f g SCHRADER, Bernhard. Infrared and Raman Spectroscopy: Methods and Applications. New York : VCH, Weinheim, 1995. ISBN 978-3-527-26446-9. S. 7-8, 15, 33, 192.
- ↑ ATKINS, Peter W; DE PAULA, Julio. Elements of physical chemistry. 5th. vyd. Oxford : Oxford U.P, 2009. ISBN 978-0-19-922672-6. S. 459.
- ↑ a b c SMITH, Janice Gorzynski. Organic chemistry. 3rd. vyd. New York, NY : McGraw-Hill, 2011. ISBN 978-0-07-337562-5. Chapter 13 Mass Spectrometry and Infrared Spectroscopy, s. 463–488.
- ↑ A Relation Between Internuclear Distances and Bond Force Constants. The Journal of Chemical Physics, 1934, s. 128. Dostupné online. DOI: 10.1063/1.1749433.
Zdroj
Tento článok je čiastočný alebo úplný preklad článku Infrared spectroscopy na anglickej Wikipédii.
Text je dostupný za podmienok Creative Commons Attribution/Share-Alike License 3.0 Unported; prípadne za ďalších podmienok. Podrobnejšie informácie nájdete na stránke Podmienky použitia.
Antropológia
Aplikované vedy
Bibliometria
Dejiny vedy
Encyklopédie
Filozofia vedy
Forenzné vedy
Humanitné vedy
Knižničná veda
Kryogenika
Kryptológia
Kulturológia
Literárna veda
Medzidisciplinárne oblasti
Metódy kvantitatívnej analýzy
Metavedy
Metodika
Text je dostupný za podmienok Creative
Commons Attribution/Share-Alike License 3.0 Unported; prípadne za ďalších
podmienok.
Podrobnejšie informácie nájdete na stránke Podmienky
použitia.
www.astronomia.sk | www.biologia.sk | www.botanika.sk | www.dejiny.sk | www.economy.sk | www.elektrotechnika.sk | www.estetika.sk | www.farmakologia.sk | www.filozofia.sk | Fyzika | www.futurologia.sk | www.genetika.sk | www.chemia.sk | www.lingvistika.sk | www.politologia.sk | www.psychologia.sk | www.sexuologia.sk | www.sociologia.sk | www.veda.sk I www.zoologia.sk






