A | B | C | D | E | F | G | H | CH | I | J | K | L | M | N | O | P | Q | R | S | T | U | V | W | X | Y | Z | 0 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9
| Guanidín | |
 | |
 | |
| Všeobecné vlastnosti | |
| Sumárny vzorec | CH5N3 |
| Synonymá | Imínometánediamín |
| Fyzikálne vlastnosti | |
| Molárna hmotnosť | 59,072 g/mol |
| Ďalšie informácie | |
| Číslo CAS | 113-00-8 |
| Pokiaľ je to možné a bežné, používame jednotky sústavy SI. Ak nie je hore uvedené inak, údaje sú za normálnych podmienok. | |
Guanidín je organická zlúčenina, ktorej vzorec je HNC(NH2)2. Je to bezfarebná pevná látka, ktorá je rozpustná v polárnych rozpúšťadlách. Guanidín je silná zásada používaná vo výrobe plastov a výbušnín. Nachádza sa v moči ako bežný produkt metabolizmu bielkovín. Guanidínová skupina sa takisto nachádza vo väčších organických molekulách vrátane bočného reťazca arginínu.
Štruktúra
Guanidín je vlastne dusíkatý analóg kyseliny uhličitej. To znamená, že skupina C=O v kyseline uhličitej je nahradená C=NH skupinou a každá OH skupina je nahradená NH2 skupinou.[1] Podobne sa dá predstaviť i izobutylén ako uhlíkový analóg. Napriek jednoduchosti štruktúry guanidínu bola jeho detailná kryštalografická analýza prvýkrát opísaná až 148 rokov po jeho prvej syntéze.[2] V roku 2013 bola presne určená pozícia vodíkových atómov pomocou jednokryštálovej neutrónovej difrakcie.[3]
Výroba
Guanidín sa dá získať z prírodných zdrojov a prvýkrát ho izoloval Adolph Strecker rozkladom guanínu.[4] Prvýkrát bol syntetizovaný v roku 1861 oxidatívnou degradáciou aromatického prírodného produktu, guanínu, izolovaného z peruánskeho guána.[5]
Laboratórnou metódou prípravy guanidínu je mierny (180 – 190 °C) tepelný rozklad suchého tiokyanátu amónneho v bezvodom prostredí:
Komerčný proces výroby sa skladá z dvoch krokov. Prvým je reakcia dikyanamidu s amónnymi soľami. Pri tejto amonolýze vzniká biguanidín, z ktorého vznikajú soli s guanidíniovým katiónom. V druhom kroku reagujú soli so zásadou, napríklad metoxidom sodným.[4]
Chemické vlastnosti
Guanidíniový katión
S pKb = 0,4 je guanidín silná zásada. Väčšina guanidínových derivátov sú v skutočnosti soli obsahujúce jeho konjugovanú kyselinu.
Konjugovaná kyselina sa nazýva guanidínium a jeho vzorec je C(NH2)3+. Je to planárny symetrický ión, ktorý pozostáva z troch amino skupín viazaných na centrálny uhlíkový atóm s kovalentnou väzbou s rádom väzby 4/3. Vo vodných roztokoch je to veľmi stabilný jednomocný katión vďaka jeho výhodnej rezonančnej stabilite náboja a efektívnej solvatácii molekulami vody. Výsledkom toho je pKaH = 13.6,[6] čo znamená, že guanidín je vo vode veľmi silná zásada. V neutrálnej vode existuje prakticky výhradne ako guanidínium.
-
3D model
-
Rezonančný hybrid
-
Rezonančné štruktúry
Skúšky na guanidín
Guanidín sa dá selektívne detegovať pomocou 1,2-naftochinón-4-sulfonátu sodného (Folinovo činidlo) a okyslenej močoviny.[7]
Použitie
Priemysel
Najväčší komerčný záujem je o dusičnan guanidínu, NO3, ktorý sa používa ako propelant napríklad v airbagoch.
Biochémia
Guanidín sa pri fyziologickom pH nachádza v protónovanej podobe ako guanidínium.
Guanidíniumchlorid je chaotropné činidlo a používa sa na denaturáciu proteínov. Guanidíniumchlorid denaturuje proteíny. Existuje lineárny vzťah medzi koncentráciou guanidíniumchloridu a voľnou energiou rozbalenia proteínu.[8] Vo vodných roztokoch, kde je koncentrácia guanidíniumchloridu 6 M, strácajú skoro všetky proteíny svoju sekundárnu štruktúru a stávajú sa z nich náhodne usporiadané peptidové reťazce. Guanidíniumtiokyanát sa takisto používa na denaturáciu rôznych biologických vzoriek.
Guanidíniumchlorid sa používa ako adjuvans pri liečbe botulizmu.[9] Prvýkrát bol použitý v roku 1968,[10] ale aktuálne sa jeho úloha pri liečbe pokladá za kontroverznú[11] – u niektorých pacientov totiž po podaní lieku nenastalo zlepšenie.
Iné
Guanidíniumhydroxid je aktívnou látkou niektorých vlasových relaxérov (prípravkov na vyrovnanie vlasov) bez lúhu.
Deriváty guanidínu
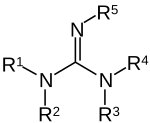
Guanidíny sú skupina organických zlúčenín, ktoré obsahujú spoločnú funkčnú skupinu, ktorej všeobecná štrukúra je (R1R2N)(R3R4N)C=NR5. Centrálna väzba na túto skupinu je imínová a táto skupina je štruktúrne podobná amidínom a močovinám. Príkladom guanidínov sú arginín, kreatín, triazabicyklodecén a saxitoxín. Galegín je izoamylén guanidínu.[12]
Referencie
- ↑ First structural characterization of guanidine. Chem. Commun., 2007, s. 3180–2. DOI: 10.1039/B705100J. PMID 17653381.
- ↑ Solid-state structure of free base guanidine achieved at last. Chem. Eur. J., 2009, s. 5651–5. DOI: 10.1002/chem.200900508. PMID 19388036.
- ↑ Single-Crystal Neutron Diffraction Study on Guanidine, CN3H5. Cryst. Growth Des., 2013, s. 1730–5. DOI: 10.1021/cg400054k.
- ↑ a b GÜTHNER, Thomas; MERTSCHENK, Bernd; SCHULZ, Bernd. Guanidine and Derivatives. Weinheim, Germany : Wiley-VCH Verlag GmbH & Co. KGaA, 2006-07-15. DOI: 10.1002/14356007.a12_545.pub2. Dostupné online. ISBN 978-3-527-30673-2. DOI:10.1002/14356007.a12_545.pub2 S. a12_545.pub2. (po anglicky)
- ↑ STRECKER, A.. Untersuchungen über die chemischen Beziehungen zwischen Guanin, Xanthin, Theobromin, Caffeïn und Kreatinin. Liebigs Ann. Chem., 1861, s. 151–177. Dostupné online. DOI: 10.1002/jlac.18611180203.
- ↑ PERRIN, D. D.. Dissociation Constants of Organic Bases in Aqueous Solution. Supplement. vyd. London : Butterworths, 1972. .
- ↑ SULLIVAN, M. X.. A Colorimetric Test for Guanidine. Proceedings of the Society for Experimental Biology and Medicine, 1935-10-01, s. 106–108. ISSN 0037-9727. DOI: 10.3181/00379727-33-8270C. (po anglicky)
- ↑ SMITH, J. S.; SCHOLTZ, J. M.. Guanidine hydrochloride unfolding of peptide helices: separation of denaturant and salt effects. Biochemistry, 1996-06-04, roč. 35, čís. 22, s. 7292–7297. PMID: 8679559. Dostupné online . ISSN 0006-2960. DOI: 10.1021/bi960341i.
- ↑ Botulism, type A, and treatment with guanidine. Annals of Neurology, 1979, s. 69–71. DOI: 10.1002/ana.410060117. PMID 389150.
- ↑ Botulism and Guanidine: Ten Years Later. J. Am. Med. Assoc., 1978, s. 2276–7. DOI: 10.1001/jama.1978.03290210058027. PMID 702753.
- ↑ BROOK, Itzhak. Pediatric Anaerobic Infections: Diagnosis and Management. 3rd. vyd. : Taylor & Francis, 2001. ISBN 0824741862. S. 529.
- ↑ The blooming of the French lilac. Journal of Clinical Investigation, 2001, s. 1105–7. DOI: 10.1172/JCI14178. PMID 11602616.
Zdroj
Tento článok je čiastočný alebo úplný preklad článku Guanidine na anglickej Wikipédii.
Text je dostupný za podmienok Creative Commons Attribution/Share-Alike License 3.0 Unported; prípadne za ďalších podmienok. Podrobnejšie informácie nájdete na stránke Podmienky použitia.
Antropológia
Aplikované vedy
Bibliometria
Dejiny vedy
Encyklopédie
Filozofia vedy
Forenzné vedy
Humanitné vedy
Knižničná veda
Kryogenika
Kryptológia
Kulturológia
Literárna veda
Medzidisciplinárne oblasti
Metódy kvantitatívnej analýzy
Metavedy
Metodika
Text je dostupný za podmienok Creative
Commons Attribution/Share-Alike License 3.0 Unported; prípadne za ďalších
podmienok.
Podrobnejšie informácie nájdete na stránke Podmienky
použitia.
www.astronomia.sk | www.biologia.sk | www.botanika.sk | www.dejiny.sk | www.economy.sk | www.elektrotechnika.sk | www.estetika.sk | www.farmakologia.sk | www.filozofia.sk | Fyzika | www.futurologia.sk | www.genetika.sk | www.chemia.sk | www.lingvistika.sk | www.politologia.sk | www.psychologia.sk | www.sexuologia.sk | www.sociologia.sk | www.veda.sk I www.zoologia.sk